
【题目】I.利用液化石油气中的丙烷脱氢可制取丙烯:C3H8(g)![]() C3H6(g)+H2(g) △H,起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷与丙烯的物质的量分数如图所示(已知p1为0.1MPa)。
C3H6(g)+H2(g) △H,起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷与丙烯的物质的量分数如图所示(已知p1为0.1MPa)。

(1)反应的△H_____0(填“>”“<”“=”下同)压强P2______0.1MPa
(2)图中A点丙烷的转化率为________。
(3)若图中A、B两点对应的平衡常数用K(A)、K(B)表示,则K(A)______K(B) (填“>”“<”或“=”)。
II.为摆脱对石油的过渡依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示。一个电极通入氧气,另一个电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO3晶体,它在高温填能传导O2-。

(1)以辛烷(C8H18)代替汽油.写出该电池工作时的负极反应方程式:______。
(2)己知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH______g。
Ⅲ.煤燃烧产生的CO2是造成温室效应的主要气体之一。我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为原子利用率=(预期产物的总质量/全部反应物的总质量)×100%,将CO2转化成有机物可有效地实现碳循环,如:
a.6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
b.2CO2 + 6H2![]() C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4![]() CH3COOH
CH3COOH
d.2CO2 + 6H2![]() CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是_______,反应d中理论上原子利用率为________。
【答案】 > < 50% < C8H1850e+25O2=8CO2+9H2O 80 a 28%
【解析】I.(1)本题考查勒夏特列原理,随着温度的升高,丙烷的物质的量分数降低,说明升高温度,平衡正向移动,正反应方向是吸热反应,即△H>0;作等温线,因反应前气体系数之和小于反应后气体系数之和,随着压强的增大,平衡向逆反应方向进行,丙烷的物质的量分数增大,根据图像推出P2<0.1Pa;(2)考查转化率的计算,令丙烷起始的物质的量amol, C3H8(g)![]() C3H6(g)+H2(g)
C3H6(g)+H2(g)
起始量:a 0 0
变化量:x x x
平衡量:a-x x x 图中A点达到平衡是丙烷和丙烯的物质的量分数相等,因此有(a-x)/(a+x)=x/(a+x),解得x=a/2,则丙烷的转化率为a/2a×100%=50%;(3)因为化学平衡常数只受温度的影响,此反应的正反应是吸热反应,升高温度平衡向正反应方向进行,B点温度比A点温度高,因此有 K(A)<K(B);II.考查电极反应式书写以及电化学计算,(1)电解质为固体,高温传导O2-,根据电池工作原理,通辛烷的一极为负极,辛烷中的C转变成CO2,H转变成H2O,电极反应式为C8H18+25O2--50e-=8CO2+9H2O;(2)电路中通过的电子物质的量为1.929×105/(1.602×10-19×6.02×1023)mol=2mol,阴极上产生氢氧化钠,其电极反应式为2H2O+2e-=H2↑+2OH-,因此当通过2mol电子时,产生氢氧化钠的质量为2×40g=80g;III.考查原子利用率的计算,a选项利用太阳能,其余选项都需要加热,因此最节能的是a,根据d反应方程式,生成28g乙烯的同时,还生成72g的H2O,因此原子利用率为28/(28+72)×100%=28%。


科目:高中化学 来源: 题型:
【题目】现有一份NaOH固体样品,里面混有少量的Na2CO3、NaCl杂质,某同学用中和滴定的方法来测定NaOH的纯度。其操作如下:
①称取a g样品放入锥形瓶中,加水,振荡,使固体充分溶解。
②向该溶液中加入足量的BaCl2溶液,使CO![]() 沉淀完全。
沉淀完全。
③向所得混合液中滴入2~3滴酚酞指示剂,然后用c mol·L-1的盐酸进行滴定。
④当反应达终点时,测得消耗盐酸的体积为V mL。
⑤计算样品的纯度。
试回答下面的问题
(1)滴定终点时溶液颜色如何变化:_____________________________________________。
(2)第②步中生成的BaCO3沉淀未过滤出来就直接用盐酸滴定,是否会对NaoH的含量测定造成影响(填“是”或“否”)___________,理由是_______________________________。
(3)第②步中生成的BaCO3沉淀未过滤出来就直接用盐酸滴定,能否改用甲基橙作指示剂(填“能”或“否”)__________。若改用甲基橙作指示剂则实验结果_______________(填“偏大”、“偏小”或“不变”)。
(4)根据上述实验数据,写出计算NaOH纯度的表达式
__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述不正确的是( )
A.油脂水解的产物是水和CO2 B.油脂水解可得到丙三醇
C.淀粉水解的最终产物是葡萄糖 D.蛋白质水解的最终产物是氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4 NH3(g)+5O2(g)![]() 4NO(g)+6 H2O(g),下列叙述正确的是
4NO(g)+6 H2O(g),下列叙述正确的是
A. NH3和H2O化学反应速率关系是2v正(NH3)= 3v正(H2O)
B. 达到化学平衡时,4v正(O2)= 5v逆(NO )
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列使用加碘盐的方法正确的有( )
①菜烧好出锅前加盐 ②先将盐、油放锅里加热,再加入食材烹饪
③煨汤时,将盐和食材一起加入 ④先将盐放在热锅里炒一下,再加入食材烹饪
A. ① B. ② ③ ④ C. ③ ④ D. ① ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数, B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。

(1)基态E原子的价电子排布图_______________。
(2)B、C、D三元素第一电离能由大到小的顺序为(用元素符号表示)______________。
(3)BD32-中心原子杂化轨道的类型为________杂化;CA4+的空间构型为__________(用文字描述)。
(4)1mol BC-中含有π键的数目为______NA。
(5)D、E元素最简单氢化物的稳定性 > (填化学式),理由是 。
(6)C、F两元素形成的某化合物的晶胞结构如右图所示,则该化合物的化学式是 ,C原子的配位数是 。若相邻C原子和F原子间的距离为anm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将22.4 g 铁粉逐渐加入到含HNO3 0.8 mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备溴乙烷的装置(已知溴乙烷的沸点38.4℃)。步骤如下:

①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在园底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
已知:NaBr+H2SO4=HBr+NaHSO4
请回答下列问题:
(1)写出烧瓶中制备溴乙烷的化学方程式_______________________________________。
(2)溴乙烷的水溶性_____________(填“大于”“等于”或“小于”)乙醇的水溶性,其原因是_________________________________。
(3)反应时若温度过高,会有副反应发生,写出相应的化学方程式___________________________。(任写一个)
(4)反应结束后,U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的_________________(填序号)
A.H2O B.Na2SO3溶液 C.CCl4 D.NaOH溶液
除杂所需的主要玻璃仪器是______________(填仪器名称)。
(5)检验溴乙烷中溴元素:取少量溴乙烷,然后__________________(氨正确的操作顺序填序号)。
①加热; ②加入AgNO3溶液; ③加入稀HNO3酸化; ④冷却; ⑤加入NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。

①写出该反应的热化学方程式: 。
②能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂。
(2)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备HCOOH原理的示意图。根据要求回答问题:
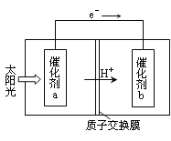
①该过程是将 转化为 。(以上两空选填“电能”“太阳能”“化学能”)
②催化剂b表面的电极反应方程式为 。
(3)某国科研人员提出了使用氢气和汽油(汽油化学式用C8H18表示)混合燃料的方案,以解决汽车CO2的排放问题。该方案主要利用储氢材料CaH2产生H2和用汽油箱贮存汽油供发动机使用,储氢系统又捕集汽油燃烧产生的CO2,该系统反应如下图所示:
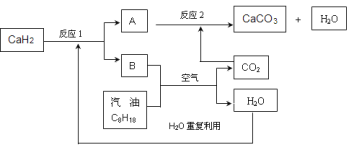
解决如下问题:
①写出CaH2的电子式 。
②反应1中氧化剂与还原剂的物质的量之比是: 。
③如该系统反应均进行完全,试写出该系统总反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com