
【题目】将22.4 g 铁粉逐渐加入到含HNO3 0.8 mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是

【答案】C
【解析】试题分析:Fe与稀硝酸反应n(Fe)="22.4/56=0.4" mol,设稀HNO3完全反应,消耗Fe为xmol,设生成Fe(NO3)3为y mol据反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O得,x=0.2mol,Fe过量(0.4-0.2)=0.2mol,继续加入Fe粉,不再产生NO气体,过量的铁与Fe(NO3)3发生反应,Fe+2Fe(NO3)33Fe(NO3)2,完全反应还只需加0.1molFe ,A、生成0.2mol气体需用0.2mol铁,A项错误;B、生成0.2mol气体需用0.2mol铁,B项错误;C、据以上分析,C项正确;D、生成0.2mol气体需用0.2mol铁,D项错误;答案选C。


科目:高中化学 来源: 题型:
【题目】当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因。煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一。
(1)已知:H2O(g)=H2O(l) △H=-44 kJ·mol-1
物质 | H2(g) | C(s) | CO(g) |
燃烧热kJ·mol-1 | 285.8 | 393.5 | 283.0 |
⑴请写出煤的气化反应生成合成气(CO和H2)的热化学方程式_______。
②在恒温、恒容的反应器中,能表明上述反应达到平衡状态的是_______。
a.混合气体平均相对分子质量不再改变
b.气体压强不再改变
c.各气体浓度相等
d.反应体系中温度保持不变
e.断裂氢氧键速率是断裂氢氧键速率的2倍
f.混合气体密度不变
g.单位时间内,消耗水的质量与生成氢气的质量比为9:1
(2)甲醇是重要的化工原料,又可作为燃枓。工业上利用合成气(主要成分为CO、CO2、H2)在催化剂的作用下合成甲醇,其中部分主反应如下:
CO2(g)+3H2(g)![]() CH3OH (g) +H2O(g) △H=-58kJ/mol
CH3OH (g) +H2O(g) △H=-58kJ/mol
①请推断该反应自发进行的条件为____________
②若将lmolCO2和2molH2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应。测得CH3OH的物质的量随时间的变化如图所示。
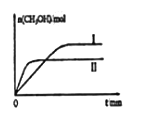
曲线I、II对应的平衡常数大小关系为KI__KII(填“>”或“=”或“<”);若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为_____,该温度下的平衡常数为___;若容器容积不变,下列措施可增加甲醇产率的是_____。
a.升高温度b.使用合适的催化剂 c.充入He d.按原比例再充入CO2和H2
(3)CH4燃料电池利用率很高,装置中添加1L 2 mol·L-1 的KOH溶液为电解质,持续缓慢通入标准状况下甲烷2.24L时负极电极反应为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 二氧化锰和浓盐酸反应:MnO2+4H++4Cl- ![]() Mn2++2Cl2+2H2O
Mn2++2Cl2+2H2O
B. 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C. 往酸性碘化钾溶液中滴加适量的双氧水:2H++2I-+H2O2=I2↑+2H2O
D. 向NaHSO4溶液中滴加Ba(OH)2溶液反应至中性:H++SO42+ Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.利用液化石油气中的丙烷脱氢可制取丙烯:C3H8(g)![]() C3H6(g)+H2(g) △H,起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷与丙烯的物质的量分数如图所示(已知p1为0.1MPa)。
C3H6(g)+H2(g) △H,起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷与丙烯的物质的量分数如图所示(已知p1为0.1MPa)。

(1)反应的△H_____0(填“>”“<”“=”下同)压强P2______0.1MPa
(2)图中A点丙烷的转化率为________。
(3)若图中A、B两点对应的平衡常数用K(A)、K(B)表示,则K(A)______K(B) (填“>”“<”或“=”)。
II.为摆脱对石油的过渡依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示。一个电极通入氧气,另一个电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO3晶体,它在高温填能传导O2-。

(1)以辛烷(C8H18)代替汽油.写出该电池工作时的负极反应方程式:______。
(2)己知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH______g。
Ⅲ.煤燃烧产生的CO2是造成温室效应的主要气体之一。我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为原子利用率=(预期产物的总质量/全部反应物的总质量)×100%,将CO2转化成有机物可有效地实现碳循环,如:
a.6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
b.2CO2 + 6H2![]() C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4![]() CH3COOH
CH3COOH
d.2CO2 + 6H2![]() CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是_______,反应d中理论上原子利用率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素。从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害。下图是用高炉烟尘制取硫酸锌的工业流程。

已知:
①20℃时,0.1mol.L-1的金属离子沉淀时的pH
pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
②过二硫酸铵是一种强氧化剂。
③ZnSO4+4NH3═[Zn(NH3)4]SO4,[Zn(NH3)4]SO4易溶于水。
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?(举出1种)_____________。
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是_____________。
(3)加入MnO2的目的是_____________。
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式_____________。
(5)写出还原过程发生的主要反应的离子方程式_____________。
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是_____________
A.锌粉 B.氨水 C.( NH4)2CO3 D. NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,并说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法 是 。
(3)上述装置图中,B的名称是 ,D仪器的名称是 。
(4)B仪器使用前必须进行的操作是 。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,正丁醛在 层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是 ,为更好的控制温度,可以采取的改进措施是 。
(7)本实验中,正丁醛的产率为 %。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验。通入SO2气体,将带火星的木条插入试管C中的溶液上方,木条复燃。
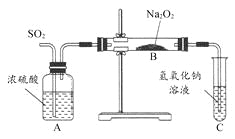
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是 。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3: 。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理? 。请简要说明两点理由:① ;② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一,
可采用苯乙腈为原料在实验室进行合成。请回答:
(1)制备苯乙酸的装置如图(加热和夹持装置等略)。已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。

在250mL三口瓶a中加入70mL质量分数为70%的硫酸,加热至100℃,再缓缓滴入40g苯乙腈,然后升温至130℃,发生反应:

仪器b的名称是______________,其作用是______________。反应结束后加适量冷水再分离出苯乙酸粗品,加入冷水的目的是___________________________________。
(2)分离出粗苯乙酸的操作名称是______,所用到的仪器是(填字母)______。
a.漏斗 b.分液漏斗 c.烧杯 d.玻璃棒 e.直形冷凝管
(3)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入Cu(OH)2,搅拌30min,过滤,滤液静置一段时间可以析出苯乙酸铜晶体,写出发生反应的化学方程式__________________,混合溶剂中乙醇的作用是________________________________________________________。
(4)提纯粗苯乙酸最终得到44g纯品,则苯乙酸的产率是_________。
(相对分子质量:苯乙腈 117,苯乙酸 136)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com