
����Ŀ����ǰ�����ɢ��ú��û������ú������й������������߶�����������Ҫԭ��ú�������ǽ����������������ú̿����Ҫ;��֮һ��
(1)��֪��H2O(g)=H2O(l) ��H=-44 kJ��mol-1
���� | H2(g) | C(s) | CO(g) |
ȼ����kJ��mol-1 | 285.8 | 393.5 | 283.0 |
����д��ú��������Ӧ���ɺϳ���(CO��H2)���Ȼ�ѧ����ʽ_______��
���ں��¡����ݵķ�Ӧ���У��ܱ���������Ӧ�ﵽƽ��״̬����_______��
a.�������ƽ����Է����������ٸı�
b.����ѹǿ���ٸı�
c.������Ũ�����
d.��Ӧ��ϵ���¶ȱ��ֲ���
e.���������������Ƕ������������ʵ�2��
f.��������ܶȲ���
g.��λʱ���ڣ�����ˮ������������������������Ϊ9:1
(2)�״�����Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ������ҵ�����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״������в�������Ӧ���£�
CO2(g)+3H2(g)![]() CH3OH (g) +H2O(g) ��H=-58kJ/mol
CH3OH (g) +H2O(g) ��H=-58kJ/mol
�����ƶϸ÷�Ӧ�Է����е�����Ϊ____________
������lmolCO2��2molH2�����ݻ�Ϊ2L�ĺ����ܱ������У������ֲ�ͬ�¶��·�����Ӧ�����CH3OH�����ʵ�����ʱ��ı仯��ͼ��ʾ��
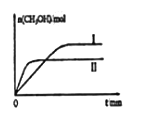
����I��II��Ӧ��ƽ�ⳣ����С��ϵΪKI__KII(�>����=����<��)����5min��Ӧ�ﵽƽ��״̬��H2��ת����Ϊ90%������CO2��ʾ��ƽ����Ӧ����Ϊ_____�����¶��µ�ƽ�ⳣ��Ϊ___���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���_____��
a.�����¶�b.ʹ�ú��ʵĴ��� c.����He d.��ԭ�����ٳ���CO2��H2
(3)CH4ȼ�ϵ�������ʺܸߣ�װ��������1L 2 mol��L-1 ��KOH��ҺΪ����ʣ���������ͨ���״���¼���2.24Lʱ�����缫��ӦΪ_________________��
���𰸡� C(s)+H2O(g)=CO(g)+H2(g) ��H=+131.3kJ/mol abef ���ڸ÷�Ӧ��S<0, ��H<0,�ʸ��ݡ�G=��H-T ��S<0��Ӧ�Է������жϸ÷�Ӧ�ڵ������Է����С� > 0.06mol/(L��min) 450 d CH4-8e-+10OH-=CO32-+7H2O
����������1���ٱ��⿼���Ȼ�ѧ��Ӧ����ʽ�ļ��㣬��C(s)��O2(g)=CO2(g) ��H=��393.5kJ��mol��1����H2(g)��1/2O2(g)=H2O(l) ��H=��285.8kJ��mol��1����CO(g)��1/2O2(g)=CO2(g) ��H=��283.0kJ��mol��1����H2O(g)=H2O(l) ��H=��44kJ��mol��1��
�٣��ܣ��ڣ��۵õ���C(s)+H2O(g)=CO(g)+H2(g) ��H=(��393.5��44��285.8��283.0)kJ��mol��1=��131.3kJ��mol��1���ڱ��⿼�黯ѧƽ��״̬���жϣ�a������M=m/n��CΪ���壬���ŷ�Ӧ������������������������ʵ���������˵�ƽ��Ħ���������ֲ��䣬˵����Ӧ�ﵽƽ�⣬��a��ȷ��b����Ӧǰ������ϵ��֮�Ͳ���ȣ���˵�ѹǿ���䣬˵����Ӧ�ﵽƽ�⣬��b��ȷ��c����Ϊû��˵����ʼʱ��Ͷ�����Լ�ת���ʣ����Ũ����ȣ�����˵����Ӧ�ﵽƽ�⣬��c����d����Ӧ���Ǻ���״̬���¶�ʼ�ձ��ֲ��䣬����¶Ȳ��䣬����˵����Ӧ�ﵽƽ�⣬��d����e���ò�ͬ���ʵ����ʱ�ʾ�ﵽƽ�⣬Ҫ��Ӧ����һ��һ�棬����H��O����˵����Ӧ������Ӧ������У�����H��H����˵����Ӧ���淴Ӧ������У�Ȼ������֮�ȵ��ڻ�ѧ������֮�ȣ�1molH2O�к���2molH��O����1molH2�к���1molH��H����˶��������������Ƕ������������ʵ�2����˵����Ӧ�ﵽƽ�⣬��e��ȷ��f�������ܶȵĶ��壬��ΪC�ǹ��壬���������������Ӧ���Ǻ���״̬�����������䣬���ܶȲ��䣬˵����Ӧ�ﵽƽ�⣬��f��ȷ��g����Ӧ������������Ӧ������У���λʱ���ڣ�����ˮ������������������������Ϊ9:1������˵����Ӧ�ﵽƽ�⣬��g����2���ٿ����жϻ�ѧ��Ӧ���еķ����ݡ�G=��H��T��S�����ݷ�Ӧ����ʽ���Ƴ���H<0����S<0������Է����У���G<0������ڵ������ܹ��Է����У��ڿ��黯ѧƽ��ļ��㡢��ѧƽ�ⳣ������������ԭ��������ͼ���ȴﵽƽ�⣬˵����Ӧ���ʿ죬��II���¶ȸ���I����Ϊ�÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ���¶�����ƽ�����淴Ӧ�����ƶ������KII<KI����������2��90%mol=1.8mol��ͬʱ����CO2�����ʵ���Ϊ1.8/3mol=0.6mol�����CO2��ת����Ϊ0.6/(2��5)mol/(L��min)=0.06 mol/(L��min)��CO2(g)+3H2(g)![]() CH3OH (g) +H2O(g)
CH3OH (g) +H2O(g)
��ʼŨ�ȣ�0.5 1 0 0
�仯Ũ�ȣ�0.3 0.9 0.3 0.3
ƽ��Ũ��: 0.2 0.1 0.3 0.3 ����ƽ�ⳣ���Ķ��壬K= ![]() =
= ![]() =450��a������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ����״��IJ��ʽ��ͣ���a����b�������Ի�ѧƽ����Ӱ�죬�״����ʲ��䣬��b����c������״̬�£�����Ƿ�Ӧ���壬���Ũ�ȶȲ��䣬ƽ�ⲻ�ƶ�����c����d���൱����ԭ���Ļ���������ѹǿ��ƽ��������Ӧ�����ƶ����״��IJ�����ߣ���d��ȷ����3������缫��Ӧʽ����д��ȼ�ϵ���൱��ȼ�գ����ͨ�����һ��Ϊ�����������Ǽ��˵缫��ӦʽΪ��CH4-8e��+10OH��=CO32��+7H2O��
=450��a������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ����״��IJ��ʽ��ͣ���a����b�������Ի�ѧƽ����Ӱ�죬�״����ʲ��䣬��b����c������״̬�£�����Ƿ�Ӧ���壬���Ũ�ȶȲ��䣬ƽ�ⲻ�ƶ�����c����d���൱����ԭ���Ļ���������ѹǿ��ƽ��������Ӧ�����ƶ����״��IJ�����ߣ���d��ȷ����3������缫��Ӧʽ����д��ȼ�ϵ���൱��ȼ�գ����ͨ�����һ��Ϊ�����������Ǽ��˵缫��ӦʽΪ��CH4-8e��+10OH��=CO32��+7H2O��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ӧ����㷺�Ľ����������������ܹ�ע����֪��
��2Fe2O3(s)+3C(s)![]() 4Fe(s)+3CO2(g) ��H=��460.5kJ/mol
4Fe(s)+3CO2(g) ��H=��460.5kJ/mol
��Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ��H=-28.5kJ/mol
2Fe(s)+3CO2(g) ��H=-28.5kJ/mol
�� ����lmol CO(s)�����еĻ�ѧ����Ҫ����1O76kJ������
����lmolCO2(s)�����еĻ�ѧ����Ҫ����1490kJ������
��ش��������⣺
��l������1molC(s)�����л�ѧ����Ҫ���յ�����Ϊ_________��
��2��T1��ʱ�����ܱ������м���һ������Fe2O3��C��������Ӧ�٣��ﵽƽ���CO2��Ũ��Ϊa mol/L�������������䣬��С�����ݻ����ٴδﵽƽ��ʱ��CO2��Ũ��Ϊbmol/L����a____b ��ѡ�>����<����=������
��3����ʼ�¶Ⱦ�ΪT2��ʱ�����ݻ�Ϊ10L�����������ܱ������У��ֱ����һ������Fe2O3��CO������Ӧ�ڣ����������������ʾ��
��� | ���� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | ƽ�ⳣ��(K) | |
Fe2O3 | CO | Fe | |||
1 | ���� | 0.5 | 1.5 | 0.8 | K1 |
2 | ���� | 2 | 3 | m | K2 |
3 | ���� | 1 | 1.5 | n | K3 |
��T2��ʱ������1�з�Ӧ��ƽ�ⳣ��Kl=_______��
������2�У�5min�ﵽƽ�⣬��0��5min����CO2��ʾ�÷�Ӧ������v(CO2)=_____��
�۶������������еķ�Ӧ������˵����ȷ���ǣ���ѡ����ĸ��________��
A.m>2n B. ����1������2��CO��ƽ��ת����al<a2
C. K1=K3 D. ƽ��ʱ����ѹǿ��P3>Pl
��4��T2��ʱ�����ѹ�ܱ������г���0.5molFe2O3��1.0molCO��������Ӧ�� ��CO��CO2�����ʵ���Ũ�ȣ�c����ʱ�䣨t���Ĺ�ϵ��ͼ��ʾ��

6minʱ���ı���������Ϊ_________������Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ľṹ��ʽ��ͼ��ʾ������˵������ȷ����

A. �����������ķ���ʽΪC17H24O3
B. ������������ˮ�м������ܣ����Ҵ����ͪ�����ܽ�
C. �������������Է����ӳɡ�ȡ������ȥ�ȷ�Ӧ
D. 1 mol������������������1mol NaOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ��NaOH������Ʒ���������������Na2CO3��NaCl������ijͬѧ���к͵ζ��ķ������ⶨNaOH�Ĵ��ȡ���������£�
�ٳ�ȡa g��Ʒ������ƿ�У���ˮ����ʹ�������ܽ⡣
�������Һ�м���������BaCl2��Һ��ʹCO![]() ������ȫ��
������ȫ��
�������û��Һ�е���2��3�η�ָ̪ʾ����Ȼ����c mol��L��1��������еζ���
�ܵ���Ӧ���յ�ʱ�����������������ΪV mL��
�ݼ�����Ʒ�Ĵ��ȡ�
�Իش����������
(1)�ζ��յ�ʱ��Һ��ɫ��α仯��_____________________________________________��
(2)�ڢڲ������ɵ�BaCO3����δ���˳�����ֱ��������ζ����Ƿ���NaoH�ĺ����ⶨ���Ӱ��(��ǡ���)___________��������_______________________________��
(3)�ڢڲ������ɵ�BaCO3����δ���˳�����ֱ��������ζ����ܷ���ü�����ָʾ��(��ܡ���)__________�������ü�����ָʾ����ʵ����_______________���ƫ����ƫС�����䡱����
(4)��������ʵ�����ݣ�д������NaOH���ȵı���ʽ
__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£��������ˮϡ��������Һ�ĵ���������ͼ��ʾ����ش�

(1)O��Ϊʲô������_________________��
(2)a��b��c������Һc��H+����С�����˳�� ��___________��
(3)a��b��c�����д���ĵ���̶������� _______�㡣
(4)��Ҫ��b����Һ��c��CH3COO-����c��OH-������С���ɲ��õķ�����___________��ѡ����ȷ��ѡ�
A.��ˮ B����NaOH C����H2SO4 D����Na2CO3
(5)��Ҫʹc����Һ�е�c(CH3COO��)��ߣ����Բ�ȡ���д�ʩ�е�________(����ĸ ���)��
A.���� B.��NaOH���� C.��ˮ D.�ӹ���CH3COONa
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڹ輰����������ʡ���;�й������У�����ȷ���ǣ� ��
A. ����������õİ뵼�����B. �赥�ʿ���������̫���ܵ��
C. ���������ǹ��ά����D. �����¶������費����NaOH��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ѧ�Ͼ���ʹ����˴Ź����ף����Ǹ��ݲ�ͬ��ѧ��������ԭ������˴Ź������и������źŲ�ͬ��ȷ���л�������еIJ�ͬ��ԭ�ӡ������л����������˴Ź�������ֻ����һ���źŵ���
A. CH3 O CH3 B. CH3 CH2OH C. HCOOH D. CH3COOCH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ࡢ֬���͵�������ά����������������������Ӫ�����ʡ�������������ȷ���ǣ� ��
A����֬ˮ��IJ�����ˮ��CO2 B����֬ˮ��ɵõ�������
C������ˮ������ղ����������� D��������ˮ������ղ����ǰ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����22.4 g �������뵽��HNO3 0.8 mol��ϡ�����У���Ӧ���ɵ���������ʵ���(x)���������۵����ʵ���(y)�仯��ϵ����ȷ����

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com