
【题目】研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。

①写出该反应的热化学方程式: 。
②能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂。
(2)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备HCOOH原理的示意图。根据要求回答问题:
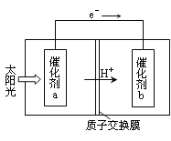
①该过程是将 转化为 。(以上两空选填“电能”“太阳能”“化学能”)
②催化剂b表面的电极反应方程式为 。
(3)某国科研人员提出了使用氢气和汽油(汽油化学式用C8H18表示)混合燃料的方案,以解决汽车CO2的排放问题。该方案主要利用储氢材料CaH2产生H2和用汽油箱贮存汽油供发动机使用,储氢系统又捕集汽油燃烧产生的CO2,该系统反应如下图所示:
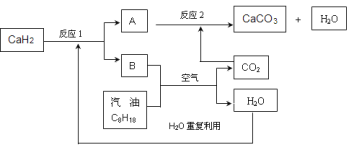
解决如下问题:
①写出CaH2的电子式 。
②反应1中氧化剂与还原剂的物质的量之比是: 。
③如该系统反应均进行完全,试写出该系统总反应的化学方程式 。
【答案】
(1)①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H =-49 kJ·mol-1(3分))②bd (2分,多选错选0分,漏选1个给1分)
CH3OH(g)+H2O(g) △H =-49 kJ·mol-1(3分))②bd (2分,多选错选0分,漏选1个给1分)
(2)①太阳能 化学能(各1分) ②CO2+2e-+2H+=HCOOH(2分)
(3)①![]() (2分)
(2分)
②2:1 (2分) ③16CaH2+ 2C8H18+41O2=16CaCO3+34 H2O(2分)
【解析】
试题分析:(1)①由所给能量变化示意图可知,1mol CO2和3molH2转化率达100%时放出热量49kJ,所以该反应的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H =-49 kJ·mol-1
CH3OH(g)+H2O(g) △H =-49 kJ·mol-1
②a、该反应是在恒压容器中进行,所以压强始终不变,不能判断该反应达到化学平衡状态,错误;b、达平衡时,各物质的含量都不再改变,氢气的体积分数恒定,可以判断该反应达到化学平衡状态,正确c、平衡时,氢气和甲醇的浓度不一定具备化学计量数的比例关系,不能判断该反应达到化学平衡状态,错误;d、由于该反应是反应前后气体的物质的量改变的反应,当压强不变时,容器体积在减小,密度增大,当平衡时气体密度不再增大,保持不变,能判断该反应达到化学平衡状态,正确;e、反应的任何状态时都有2个C=O断裂的同时有6个H-H断裂,不能判断该反应达到化学平衡状态,错误,答案选bd;
(2)①该图是利用太阳能将二氧化碳转化为HCOOH,所以是把太阳能转化为化学能;②根据电子的流动方向,催化剂b相当于原电池的正极,发生还原反应,所以发生的反应为CO2+2e-+2H+=HCOOH;
(3)①CaH2是离子化合物,其电子式为![]() ;
;
②反应1是CaH2与H2O反应生成氢氧化钙和氢气,反应中CaH2作还原剂,水作氧化剂,可写出发生的化学方程式CaH2+2H2O=Ca(OH)2+H2↑,所以氧化剂与还原剂的物质的量之比是2:1;
③由反应的流程图可知,最终产物是CaCO3 、H2O。反应1生成的氢气与氧气反应生成水,汽油与氧气反应生成二氧化碳和水,其中二氧化碳用于和反应1产生的氢氧化钙的反应,将发生反应的化学方程式叠加,消去中间产物二氧化碳、氢气、氢氧化钙,最后的产物只有水和碳酸钙,所以总反应方程式为16CaH2+ 2C8H18+41O2=16CaCO3+34H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】I.利用液化石油气中的丙烷脱氢可制取丙烯:C3H8(g)![]() C3H6(g)+H2(g) △H,起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷与丙烯的物质的量分数如图所示(已知p1为0.1MPa)。
C3H6(g)+H2(g) △H,起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷与丙烯的物质的量分数如图所示(已知p1为0.1MPa)。

(1)反应的△H_____0(填“>”“<”“=”下同)压强P2______0.1MPa
(2)图中A点丙烷的转化率为________。
(3)若图中A、B两点对应的平衡常数用K(A)、K(B)表示,则K(A)______K(B) (填“>”“<”或“=”)。
II.为摆脱对石油的过渡依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示。一个电极通入氧气,另一个电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO3晶体,它在高温填能传导O2-。

(1)以辛烷(C8H18)代替汽油.写出该电池工作时的负极反应方程式:______。
(2)己知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH______g。
Ⅲ.煤燃烧产生的CO2是造成温室效应的主要气体之一。我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为原子利用率=(预期产物的总质量/全部反应物的总质量)×100%,将CO2转化成有机物可有效地实现碳循环,如:
a.6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
b.2CO2 + 6H2![]() C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4![]() CH3COOH
CH3COOH
d.2CO2 + 6H2![]() CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是_______,反应d中理论上原子利用率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验。通入SO2气体,将带火星的木条插入试管C中的溶液上方,木条复燃。
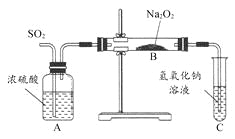
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是 。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3: 。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理? 。请简要说明两点理由:① ;② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NCl3的有关叙述正确的是( )
A.分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B.分子中的所有原子均达到8电子稳定结构
C.NCl3分子是非极性分子
D.NBr3比NCl3易挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知次氯酸分子的结构式为H—O—Cl,下列有关说法正确的是( )
A. O原子发生sp杂化 B. 该分子的电子式是H︰O︰Cl
C. 该分子为直线型分子 D. O原子与H、Cl都形成σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种重要的有机物:
![]()
![]()
![]()
![]()
请回答:
(1)能与银氨溶液反应生成乙酸铵的是______(填序号)。
(2)能发生加聚反应生成导电高分子材料的是______(填序号)。
(3)写出③与NaOH的乙醇溶液共热生成1,3-丁二烯的化学方程式_______________。
(4)写出④与甲醛反应制取酚醛树脂的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一,
可采用苯乙腈为原料在实验室进行合成。请回答:
(1)制备苯乙酸的装置如图(加热和夹持装置等略)。已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。

在250mL三口瓶a中加入70mL质量分数为70%的硫酸,加热至100℃,再缓缓滴入40g苯乙腈,然后升温至130℃,发生反应:

仪器b的名称是______________,其作用是______________。反应结束后加适量冷水再分离出苯乙酸粗品,加入冷水的目的是___________________________________。
(2)分离出粗苯乙酸的操作名称是______,所用到的仪器是(填字母)______。
a.漏斗 b.分液漏斗 c.烧杯 d.玻璃棒 e.直形冷凝管
(3)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入Cu(OH)2,搅拌30min,过滤,滤液静置一段时间可以析出苯乙酸铜晶体,写出发生反应的化学方程式__________________,混合溶剂中乙醇的作用是________________________________________________________。
(4)提纯粗苯乙酸最终得到44g纯品,则苯乙酸的产率是_________。
(相对分子质量:苯乙腈 117,苯乙酸 136)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 投入足量漂白粉后的溶液中:Fe2+、H+、Cl-、SO42-
B. 0.1mol/LFeCl3溶液中:Na+、Ba2+、NO3-、SCN-
C. ![]() 的溶液中:NH4+、Ca2+、Cl-、NO3-
的溶液中:NH4+、Ca2+、Cl-、NO3-
D. 水电离的c(OH-)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)CuCl2溶液显_____性,理由是(用离子方程式表示)____________
(II)BaSO4浊液中存在______平衡,其表达式为:__________________
(III)已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=﹣1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H2=﹣566.0kJ/mol,
③H2O(g)═H2O(l)△H3=﹣44.0kJ/mol
上述三个反应中,△S<0的是___________.甲醇燃烧生成一氧化碳和液态水的热化学方程式是______________________
(IV)已知碳酸H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11
草酸H2C2O4:Ka1=5.9×10-2,Ka2=6.4×10-5,0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”),等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种粒子浓度大小的顺序正确的是_____。(选填编号)
A.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-)
B.c(HCO3-)>c(HC2O4-)c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
D.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com