
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 投入足量漂白粉后的溶液中:Fe2+、H+、Cl-、SO42-
B. 0.1mol/LFeCl3溶液中:Na+、Ba2+、NO3-、SCN-
C. ![]() 的溶液中:NH4+、Ca2+、Cl-、NO3-
的溶液中:NH4+、Ca2+、Cl-、NO3-
D. 水电离的c(OH-)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32-
科目:高中化学 来源: 题型:
【题目】下图是实验室制备溴乙烷的装置(已知溴乙烷的沸点38.4℃)。步骤如下:

①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在园底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
已知:NaBr+H2SO4=HBr+NaHSO4
请回答下列问题:
(1)写出烧瓶中制备溴乙烷的化学方程式_______________________________________。
(2)溴乙烷的水溶性_____________(填“大于”“等于”或“小于”)乙醇的水溶性,其原因是_________________________________。
(3)反应时若温度过高,会有副反应发生,写出相应的化学方程式___________________________。(任写一个)
(4)反应结束后,U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的_________________(填序号)
A.H2O B.Na2SO3溶液 C.CCl4 D.NaOH溶液
除杂所需的主要玻璃仪器是______________(填仪器名称)。
(5)检验溴乙烷中溴元素:取少量溴乙烷,然后__________________(氨正确的操作顺序填序号)。
①加热; ②加入AgNO3溶液; ③加入稀HNO3酸化; ④冷却; ⑤加入NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。

①写出该反应的热化学方程式: 。
②能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂。
(2)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备HCOOH原理的示意图。根据要求回答问题:
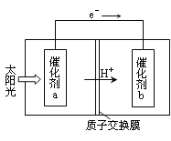
①该过程是将 转化为 。(以上两空选填“电能”“太阳能”“化学能”)
②催化剂b表面的电极反应方程式为 。
(3)某国科研人员提出了使用氢气和汽油(汽油化学式用C8H18表示)混合燃料的方案,以解决汽车CO2的排放问题。该方案主要利用储氢材料CaH2产生H2和用汽油箱贮存汽油供发动机使用,储氢系统又捕集汽油燃烧产生的CO2,该系统反应如下图所示:
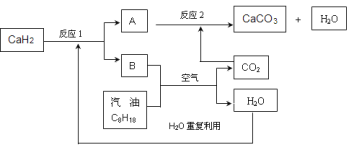
解决如下问题:
①写出CaH2的电子式 。
②反应1中氧化剂与还原剂的物质的量之比是: 。
③如该系统反应均进行完全,试写出该系统总反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石和石墨是碳元素的两种同素异形体.在100kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热量,试判断在100kPa压强下,下列结论不正确的是
A. 石墨比金刚石稳定
B. 金刚石和石墨的微观结构不同
C. lmol石墨比lmol金刚石的总能量高
D. 石墨转化为金刚石是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
以下说法不正确的是
A. 非金属性:Y>硫
B. 离子半径:Y2->S2->Z-
C. 单质氧化性:Z单质>硫单质
D. Z元素在周期表中位于第三周期第ⅦA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若已发现了116号元素则下列推断正确的是:①R是金属元素②R是非金属元素③其钠盐的化学式为Na2R④其最高价氧化物对应的水化物的酸性比硫酸强⑤最外电子层有6个电子
A. ①③④ B. ①③⑤ C. ②④⑤ D. ①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4受热分解的化学方程式为2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
请回答:
(1)将FeSO4受热产生的气体按图示装置进行实验,证实含有SO3和SO2。能说明SO2存在的实验现象是______________________;为测定BaSO4沉淀的质量,后续的操作步骤依次为________、洗涤、干燥、称量。

(2)设计一个实验方案,用化学方法验证FeSO4受热后固体的成分(不考虑其他反应)
________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )

A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1mol O2,有44gCO2被还原
D. a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识回答下列有关碳和碳的化合物的问題
⑴汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(己知该反应在一定条件下可以自发进行)。在2L密闭容器中加入一定量NO和CO,当溫度分别在T1和T2时,测得各物质平衡时物质的量如下表:
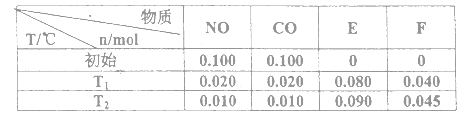
①请结合上表数据,写出NO与CO反应的化学方程式___________________,该反应的△S_______0 (填“<”或“>”)。
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。根据表中数据计算K1=_________,根据表中数据判断,温度T1和T2关系是(填序号)______________。
A. T1>T2 B. T1<T2 C.无法比较
(2)生成的CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200mL3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为____________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为:___________mol/L。(忽略混合前后溶液体积的变化)
(4)己知14gCO完全燃烧时放出141.5 kJ 的热量,则写出CO燃烧热的热化学方程式:_____________。
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池,写出其负极和正极电极反应方程式:负极:_________;正极:________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com