
【题目】下列反应能生成三价铁的是
A. 铁丝在硫蒸气中燃烧 B. 铁与硫酸铜溶液反应
C. 铁在氯气中燃烧 D. 铁与稀硫酸溶液反应
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】A (乙炔)是基本有机化工原料。由A制备高分子可降解塑料(PVB)和IR的合成路线(部分反应条件略去)如图所示。
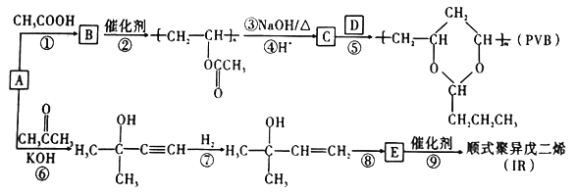
回答下列问题:
(1)实验室制备A的化学反应方程式为 ____________________________________。
(2)过程①的反应类型为____________。B中含氧官能团的名称是____________________。
(3)反应③的化学方程式为_____________________________________。反应⑧的化学方程式为_____________________________________。
(4)关于过程②,下列说法正确的是_____(填序号)。
a.反应②属于缩聚反应 b.该高分子材料可用于生产吸汗织物
c.该高分子链节具有和其单体一样的结构 d.生成的高分子化合物具有热塑性,且为混合物
e.通过质谱仪测得该高分子的平均相对分子质量为30444,可推知其n约为354
(5)D和IR的结构简式分别是_____________________、__________________。
(6)与过程⑦的产物含相同官能团的同分异构体有____种。(己知碳碳双键与羟基直接相连不稳定)
(7)已知: ,(R、R'表示烃基或氢);以A为起始原料,选用必要的无机试剂合成D,写出合成路线_____________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,(R、R'表示烃基或氢);以A为起始原料,选用必要的无机试剂合成D,写出合成路线_____________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种离效消毒剂、漂白剂在实验室中可用如图装置制备。.
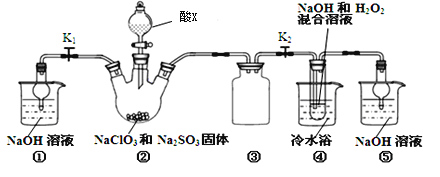
(1)装置②中酸X可以为_____________。
A.盐酸 B.H2SO4 C.HNO3 D.H2C2H4溶液
(2)写出装置②中产生ClO2的离子方程式_____________________。
(3)装置③的作用是_____________,装置④采用冷水欲的原因是__________________。
(4)由装置④反应后的溶液可得到NaClO2晶体,其实验步骤为:
ⅰ.减压,蒸发结晶;ⅱ.___________;ⅲ.热水洗涤;ⅳ.低温干燥,得到成品
(已知低温时NaClO2饱和溶液中会析出NaClO2·3H2O。)
(5)ClO2可用于氧化工厂污水中所含CN-,生成两种无毒无害的气体,写出其离子反应方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
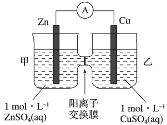
A.锌电极上发生还原反应
B.电池工作一段时间后,甲池的 c(SO42-)不变
C.电池工作一段时间后,乙池溶液的总质量减少
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
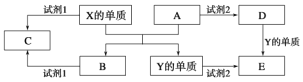
(1)X的单质与A反应的化学方程式是_______________________________。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是__________。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是_____________________________。
②写出D和Y单质反应的离子方程式:______________________________。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
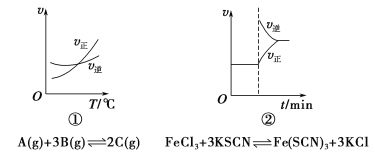
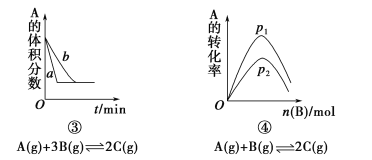
A.①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的合成对国家工业发展有着举足轻重的作用,请根据化学原理知识回答下列问题:
(1)已知氢气的燃烧热为285.8kJ/mol。
4NH3 (g) +5O2 (g) ![]() 4NO(g) + 6H2O(l) △H= —1168.8kJ/mol
4NO(g) + 6H2O(l) △H= —1168.8kJ/mol
N2(g)+ O2(g)═ 2NO(g)△H = +180.6kJ/mol。
则工业合成氨的热化学方程式为________________。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。实验结果如图所示:(图中 T表示温度, n表示物质的量)

①图像中 T2和 T1的关系是: T2 _______________ T1(填“高于”、“低于”、 “等于”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N 2 的转化率最高的是_______________(填字母)。
③在起始体系中n(N2):n(H2)= 1:3时,反应后氨的百分含量最大;若容器容积为1L, n=3mol反应达到平衡时H2的转化率为60%,则此条件下( T 2),反应的平衡常数 K=__________________。
(3)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2![]() N2O4 H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化 (气体颜色越深,透光率越小)。下列说法正确的是______________
N2O4 H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化 (气体颜色越深,透光率越小)。下列说法正确的是______________

A.b点的操作是压缩注射器
B.c点与a点相比, c(NO2)增大, c(N2O4)减小
C.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数Kb>Kc
D.d点:v(正)> v(逆)
(4)利用反应6NO2+8NH3=7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。

①电极a为___________________极,其电极反应式为__________________。
②当有0.1 mol NO2被处理时,转移电子为________________mol。
③为使电池持续放电,该离子交换膜需选用___________________交换膜。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com