
【题目】反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
![]()
下列说法不正确的是![]()
![]()
A. 反应①中![]() 是氧化剂
是氧化剂
B. 两个反应中硫元素均被氧化
C. 氧化性:![]()
D. 反应①、②中生成等量的![]() 时转移电子数之比为1:5
时转移电子数之比为1:5
【答案】B
【解析】
A.反应①中Mn元素的化合价由反应前MnO2中的+4价变为反应后MnCl2中的+2价,锰元素的化合价降低,MnO2作氧化剂,A正确;
B.在反应①中硫元素化合价不变,所以S既不被氧化也不被还原;在反应②中S元素的化合价由反应前NaHSO3中的+4价变为反应后NaHSO4中的+6价,化合价升高,失去电子,被氧化,B错误;
C.氧化剂的氧化性大于氧化产物的氧化性,根据①可知氧化性MnO2>I2;根据②可知氧化性IO3->SO42-,C正确;
D.反应①中生成1mol碘转移电子2NA,反应②中生成1mol碘转移10NA,所以反应①、②中生成等量的I2时转移电子数比为2NA :10NA =1:5,D正确;
故合理选项是B。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知:①Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;
②2SO2+SeO2+2H2O===Se+2SO42—+4H+。
(1) Se与浓H2SO4的反应中,氧化剂是________________,还原剂是_______________。当有标准状况下22.4 L SO2气体生成时,转移电子的物质的量是________ mol。
(2)依据反应①、②判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是______________________。
(3)用单线桥法标出反应②电子转移的方向和数目:_____________________________。
(4)SeO2、KI和HNO3发生如下反应:SeO2+KI+HNO3―→Se+I2+KNO3+H2O配平上述反应的化学方程式______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 78gNa2O2晶体中所含阴阳离子个数为2NA
B. 1.5gCH3+中含有的电子数为NA
C. 3.4g氨气分子中含有0.6NA个N—H键
D. 常温下,100mL1mol·L-1AlCl3溶液中Al3+离子总数等于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用废旧电池的铜帽(铜锌总含量约99%)制备了CuSO4·5H2O样品,制备流程如下:
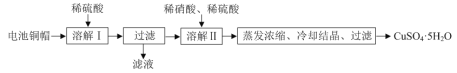
(1)“溶解Ⅱ”过程中,发生反应的离子方程式为___。
(2)“溶解Ⅱ”过程中应控制反应温度,温度不能过高的原因是___。
(3)为测定所得CuSO4·5H2O样品的纯度,兴趣小组进行了如下实验:称取2.540g样品,配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量KI并充分振荡后,滴加几滴淀粉溶液,再滴入0.0400mol·L-1的Na2S2O3溶液至刚好完全反应,恰好完全反应时消耗Na2S2O3溶液的体积为25.00 mL。实验过程中发生的反应如下:2Cu2++4I-=2CuI↓+I2、2S2O32-+I2=S4O62-+2I-
①配制250mL溶液所需的玻璃仪器除烧杯、胶头滴管外还有___。
②计算出样品中CuSO4·5H2O的质量分数。___(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数(NA)的说法错误的是( )
A. 25℃、101KPa条件下22克CO2所含的原子数目为1.5NA
B. 标准状况下0.1molH2O含有的分子数目为0.1NA
C. 0℃、101KPa条件下03NA氧气的体积是6.72升
D. 58.5克NaCl固体中含有的离子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验室某浓盐酸试剂瓶标签上的有关数据,下列说法正确的是

A. 该浓盐酸中HCl的物质的量浓度为11.9mol·L-1
B. 溶液中HCl的物质的量不随所取体积的多少而变化
C. 配制500 mL0.400 mol·L-1的稀盐酸需要量取浓盐酸1.68mL
D. 中和含0.4 g NaOH的NaOH溶液需取0.400 mol·L-1的稀盐酸2.5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.根据下列各题中所给出的数据,可分别求出其溶液中溶质的质量分数或溶液中溶质的物质的量浓度,试判断并求解。
(1)已知某氢氧化钠溶液VL中含有n个氢氧根离子,可求出此溶液的___是___。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1:a,则可求出此溶液的___为___。
Ⅱ.常温下,10.0mL1.0molL-1的H2SO4(aq),加水稀释到500mL,所得H2SO4溶液的浓度为___molL-1;蒸发浓缩使溶液的体积为2.40mL,所得H2SO4溶液的浓度为___molL-1。(结果保留小数点后一位)
Ⅲ.已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中溶质的质量分数为___。(结果保留小数点后一位)
Ⅳ.现有一混合物的水溶液,可能含有以下离子中的几种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-现取三份各100mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到![]() 气体;第三份加足量
气体;第三份加足量![]() 溶液后,得到干燥沉淀
溶液后,得到干燥沉淀![]() ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为![]() 。
。
该混合液中一定含有___,可能含___,且n(K+)___(填取值范围)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我校环保兴趣小组在处理污水样品时,需用2mol/L的盐酸配制成250mL0.1mol/L的盐酸溶液。
(1)计算所需2mol/L的盐酸的体积是_____________。
(2)在容量瓶的使用方法中,下列操作正确的是_______________。
A、使用容量瓶前检查它是否漏水
B、容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C、配制溶液时,将量筒量取好的盐酸直接倒入容量中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(3)配制时其他操作均正确,若定容时俯视刻度线,所配溶液的物质的量浓度_________。(填“偏高”;“偏低”“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A. 用惰性电极电解MgCl2溶液:2Cl—+H2O通电 2OH—+Cl2↑+H2↑
B. SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO42-+2I-+4H+
C. 氯气通入冷水中:Cl2 +H2O ![]() Cl- +ClO- +2H+
Cl- +ClO- +2H+
D. 碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com