
【题目】研究发现,由钴氧化物负载的锰氧化物纳米粒子催化剂对某些反应具有高活性,应用前景良好。回答下列问题:
(1)Mn基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是________;Mn与Co相比,基态原子核外未成对电子数较少的是_______。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)沸点相比较:
①甲醇____H2O(填写“>”“<”或“=”);原因是_____________________________;
②CO2____H2(填写“>”“<”或“=”);原因是________________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了π键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为αnm,则r(O2-)为________ nm (用含α的算式表示,不必运算化简,下同)。MnO也属于NaCl型结构,晶胞参数为αˊnm,则r(Mn2+)为________nm(用含α、αˊ的算式表示)。

【答案】1s22s22p63s23p63d54s2 或[Ar]3d54s2 OCospsp3<H2O与CH3OH均为极性分子,H2O中氢键比甲醇多>CO2与H2均为非极性分子,CO2分子量较大、范德华力较大离子键和σ键![]()
![]()
【解析】
(1)根据构造原理写基态Mn原子的核外电子排布式;第一电离能:Mn<O;基态Mn原子核外未成对电子数为5,基态Co原子核外未成对电子数为3。
(2)CO2中C原子为sp杂化,CH3OH中C原子为sp3杂化。
(3)①CH3OH和H2O都是极性分子,H2O中氢键比CH3OH多,沸点:CH3OH<H2O;
②CO2和H2都是非极性分子,CO2的相对分子质量>H2的相对分子质量,CO2的范德华力>H2的范德华力,沸点:CO2>H2。
(4)Mn(NO3)2中Mn2+与NO3-之间存在离子键,NO3-内N原子和O原子间存在σ键和π键。
(5)MgO晶胞中阴离子采用面心立方最密堆积,4r(O2-)=![]() αnm;MnO也属于NaCl型,根据“MnO的晶胞参数=2r(Mn2+)+2r(O2-)”解得r(Mn2+)。
αnm;MnO也属于NaCl型,根据“MnO的晶胞参数=2r(Mn2+)+2r(O2-)”解得r(Mn2+)。
(1)Mn的原子序数为25,Mn原子核外有25个电子,根据构造原理,基态Mn原子的核外电子排布式为1s22s22p63s23p63d54s2(或[Ar] 3d54s2);Mn为金属元素易失去电子,O为非金属元素,第一电离能:Mn<O,第一电离能较大的是O;基态Mn原子价电子排布式为3d54s2,基态Mn原子核外未成对电子数为5,基态Co原子价电子排布式为3d74s2,基态Co原子核外未成对电子数为3,基态原子核外未成对电子数较少的是Co。
(2)CO2中中心原子C的价层电子对数为![]() ×(4-2×2)+2=2,CO2中C原子为sp杂化;CH3OH中C原子形成4个σ键,C上没有孤电子对,C的价层电子对数为4,CH3OH中C原子为sp3杂化。
×(4-2×2)+2=2,CO2中C原子为sp杂化;CH3OH中C原子形成4个σ键,C上没有孤电子对,C的价层电子对数为4,CH3OH中C原子为sp3杂化。
(3)①CH3OH和H2O都是极性分子,H2O中氢键比CH3OH多(1molH2O中含2mol氢键,1molCH3OH中含1mol氢键),沸点:CH3OH<H2O;
②CO2和H2都是非极性分子,CO2的相对分子质量>H2的相对分子质量,CO2的范德华力>H2的范德华力,沸点:CO2>H2。
(4)Mn(NO3)2中Mn2+与NO3-之间存在离子键,NO3-内N原子与O原子间除了存在π键外还存在3个σ键,Mn(NO3)2中除了π键外,还有离子键和σ键。
(5)MgO晶胞中阴离子采用面心立方最密堆积,则4r(O2-)=![]() αnm,r(O2-)=
αnm,r(O2-)=![]() nm;MnO也属于NaCl型,MnO中阴、阳离子的配位数都为6,MnO的晶胞参数=2r(Mn2+)+2r(O2-),αˊnm=2r(Mn2+)+2×
nm;MnO也属于NaCl型,MnO中阴、阳离子的配位数都为6,MnO的晶胞参数=2r(Mn2+)+2r(O2-),αˊnm=2r(Mn2+)+2×![]() nm,解得r(Mn2+)=(
nm,解得r(Mn2+)=(![]() )nm。
)nm。


科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH![]() 、Cl-、Mg2+、Ba2+、CO
、Cl-、Mg2+、Ba2+、CO![]() 、SO
、SO![]() ,现取三份100 mL该溶液进行如下实验:
,现取三份100 mL该溶液进行如下实验:
(1) 第一份加入AgNO3溶液有沉淀产生;
(2) 第二份加足量NaOH溶液加热后,收集到气体0.04 mol;
(3) 第三份加足量BaCl2溶液后,干燥后得沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是( )
①K+一定存在;②100 mL溶液中含0.01 mol CO![]() ;③Cl-可能存在;
;③Cl-可能存在;
④Ba2+一定不存在;⑤Mg2+可能存在
A. ③④ B. ③④⑤
C. ①② D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g)![]() CH3OH(g) ΔH1 =-99kJ·mol-1
CH3OH(g) ΔH1 =-99kJ·mol-1
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)CO2的电子式是________________。
(2)ΔH3=______kJ·mol-1,②反应正向的熵变ΔS______0(填“>”“<”或“=”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图。
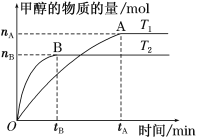
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=_____ mol·L-1·min-1。
②图示的温度T1______T2(填写“>”、“<”或“=”)
(4)T1温度时,将2 mol CO2和6 mol H2充入2 L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为________;反应②在该温度达到平衡时,其平衡常数的数值为_______。
(5)若反应②在原电池条件下实现,请写出酸性条件下惰性电极上由CO2生成CH3OH的电极反应式:____________________,该电极为原电池的_______极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的![]() (如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关
(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关![]() 的说法正确的是
的说法正确的是

A. 分子中N、O间形成的共价键是非极性键
B. 分子中四个氮原子共平面
C. 该物质既有氧化性又有还原性
D. 15.2g该物资含有6.02×![]() 个原子
个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)如图是元素周期表的一部分,回答下列问题: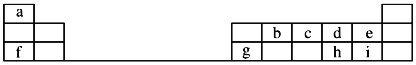
![]() 元素e的负一价离子的结构示意图为 ______ ,f、g、h、i对应简单离子的半径由大到小的顺序为 ______
元素e的负一价离子的结构示意图为 ______ ,f、g、h、i对应简单离子的半径由大到小的顺序为 ______ ![]() 用具体微粒符号表示
用具体微粒符号表示![]() .
.
![]() 元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为 ______ .
元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为 ______ .
![]() 、c、d三种原子的第一电离能大小顺为 ______
、c、d三种原子的第一电离能大小顺为 ______ ![]() 用具体微粒符号表示
用具体微粒符号表示![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关焰色反应的实验操作及注意事项正确的是( )
A.只有把盐配制成溶液才能进行焰色反应
B.实验时用铂丝直接蘸取药品在酒精灯上灼烧
C.可以用铁丝代替铂丝进行焰色反应
D.实验后要用稀硫酸将铂丝洗净
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g)![]() CH3OH(g) ΔH1 =-99kJ·mol-1
CH3OH(g) ΔH1 =-99kJ·mol-1
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)CO2的电子式是________________。
(2)ΔH3=______kJ·mol-1,②反应正向的熵变ΔS______0(填“>”“<”或“=”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图。
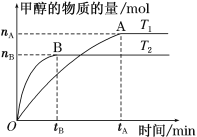
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=_____ mol·L-1·min-1。
②图示的温度T1______T2(填写“>”、“<”或“=”)
(4)T1温度时,将2 mol CO2和6 mol H2充入2 L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为________;反应②在该温度达到平衡时,其平衡常数的数值为_______。
(5)若反应②在原电池条件下实现,请写出酸性条件下惰性电极上由CO2生成CH3OH的电极反应式:____________________,该电极为原电池的_______极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com