
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g)![]() CH3OH(g) ΔH1 =-99kJ·mol-1
CH3OH(g) ΔH1 =-99kJ·mol-1
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)CO2的电子式是________________。
(2)ΔH3=______kJ·mol-1,②反应正向的熵变ΔS______0(填“>”“<”或“=”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图。
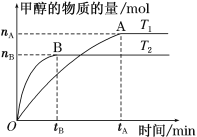
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=_____ mol·L-1·min-1。
②图示的温度T1______T2(填写“>”、“<”或“=”)
(4)T1温度时,将2 mol CO2和6 mol H2充入2 L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为________;反应②在该温度达到平衡时,其平衡常数的数值为_______。
(5)若反应②在原电池条件下实现,请写出酸性条件下惰性电极上由CO2生成CH3OH的电极反应式:____________________,该电极为原电池的_______极。
【答案】![]() +41 <
+41 < ![]() < 3∶4 0.148~0.15(或1/6.75以及4/27 ) CO2 + 6e- + 6H+ = CH3OH + H2O 正
< 3∶4 0.148~0.15(或1/6.75以及4/27 ) CO2 + 6e- + 6H+ = CH3OH + H2O 正
【解析】
(1)CO2的电子式为![]() 。
。
(2)应用盖斯定律计算ΔH3。反应②正向的ΔS<0。
(3)①根据图像中数值用公式υ=![]() 计算υ(CH3OH)。
计算υ(CH3OH)。
②用“先拐先平”法分析,图像中T2先出现拐点,T2反应速率快,则T1<T2。
(4)用三段式和化学平衡常数的表达式计算。
(5)1molCO2得到6mol电子生成1molCH3OH,结合原子守恒、电荷守恒写电极反应式;该反应为还原反应,在原电池的正极上发生。
(1)CO2的电子式为![]() 。
。
(2)分析各热化学方程式,应用盖斯定律,将②-①得,CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3=ΔH2-ΔH1=(-58kJ/mol)-(-99kJ/mol)=+41kJ/mol。反应②中气体反应物的化学计量数之和为4,气体生成物的化学计量数之和为2<4,反应②正向的ΔS<0。
CO(g)+H2O(g)ΔH3=ΔH2-ΔH1=(-58kJ/mol)-(-99kJ/mol)=+41kJ/mol。反应②中气体反应物的化学计量数之和为4,气体生成物的化学计量数之和为2<4,反应②正向的ΔS<0。
(3)①根据图像,温度为T1时,从反应到平衡反应生成CH3OH物质的量为nAmol,生成甲醇的平均速率为υ(CH3OH)=![]() mol/(L·min)=
mol/(L·min)=![]() mol/(L·min)。
mol/(L·min)。
②用“先拐先平”法分析,图像中T2先出现拐点,T2反应速率快,根据温度对化学反应速率的影响知:T1<T2。
(4)用三段式, CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
c(起始)(mol/L)1 3 0 0
c(转化)(mol/L)1×50%=0.5 1.5 0.5 0.5
c(平衡)(mol/L)0.5 1.5 0.5 0.5
在恒温恒容时气体压强之比等于气体物质的量之比,此时容器内的压强与起始压强之比为(0.5+1.5+0.5+0.5):(1+3)=3:4。该反应的平衡常数K=![]() =
=![]() =0.15。
=0.15。
(5)CO2中C元素的化合价为+4价,CH3OH中C元素的化合价为-2价,1molCO2得到6mol电子生成1molCH3OH,结合原子守恒、电荷守恒和酸性条件,CO2生成CH3OH的电极反应式为CO2+6e-+6H+=CH3OH+H2O,该反应为还原反应,该电极为原电池的正极。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】研究发现,由钴氧化物负载的锰氧化物纳米粒子催化剂对某些反应具有高活性,应用前景良好。回答下列问题:
(1)Mn基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是________;Mn与Co相比,基态原子核外未成对电子数较少的是_______。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)沸点相比较:
①甲醇____H2O(填写“>”“<”或“=”);原因是_____________________________;
②CO2____H2(填写“>”“<”或“=”);原因是________________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了π键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为αnm,则r(O2-)为________ nm (用含α的算式表示,不必运算化简,下同)。MnO也属于NaCl型结构,晶胞参数为αˊnm,则r(Mn2+)为________nm(用含α、αˊ的算式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家屠呦呦因创造性地研制出抗疟新药青蒿素和双氢青蒿素(对疟原虫有100%的抑制率)而获2015年诺贝尔医学奖。如图为青蒿素的键线式,以下关于青蒿素的说法错误的是
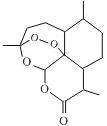
A. 含有酯基,可水解
B. 含有过氧键,有较强氧化性,且不够稳定
C. 青蒿素的化学式C15 H24O5
D. 在水中溶解度不大,易溶于有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如下图所示(气体体积数据已换算成标准状况下的体积)。关于该固体混合物,下列说法正确的是( )

A. 一定含有MgCl2和FeCl2
B. 一定不含FeCl2,可能含有MgCl2和AlCl3
C. 一定含有Al,其质量为4.5 g
D. 一定含有(NH4)2SO4和MgCl2,且物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素分别是:A________,B________,C________,D________。(填名称)
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是____________。
(3)A与B形成的三原子分子的电子式是________, B与D形成原子个数比为1∶1的化合物的电子式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是________,D是________,G是________,H是________(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:_____________________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为__________________________。
(3)A中元素的原子结构示意图为________________。
(4)上述反应中属于氧化还原反应的是_________(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对沉淀溶解平衡的描述正确的是( )
A.电解质的溶解开始后,只有电解质的溶解过程,没有电解质的析出过程
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的各离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝合金在日常生活、航空航天和汽车制造等方面均有广泛用途。下列关于铝的说法正确的是
A.铝的表面容易形成致密的氧化膜,抗腐蚀性能好
B.常温下不与任何酸、碱反应
C.铝元素在地壳中的含量高,储量丰富,仅次于铁
D.工业上通常用钠与铝盐溶液反应来制备铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com