
����Ŀ��A��B��C��D���Ƕ�����Ԫ�أ�ԭ�Ӱ뾶D>C>A>B������A��B����ͬһ���ڣ�A��C����ͬһ���塣Cԭ�Ӻ�������������A��Bԭ�Ӻ���������֮�ͣ�Cԭ��������ϵĵ�������Dԭ��������������4�����Իش�
(1)������Ԫ�طֱ��ǣ�A________��B________��C________��D________��(������)
(2)������Ԫ�����ڳ��³�ѹ�µ�Һ̬����̬�⻯����ȶ����ɴ��С��˳����____________��
(3)A��B�γɵ���ԭ�ӷ��ӵĵ���ʽ��________�� B��D�γ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ĵ���ʽ��__________��
���𰸡�̼ �� �� �� H2O>CH4>SiH4 ![]()
![]()
��������
A��B��C��D���Ƕ�����Ԫ�أ�ԭ�Ӱ뾶D>C>A>B������A��B����ͬһ���ڣ�A��C����ͬһ���壬����Ԫ�������ڱ��еĴ������λ��Ϊ��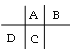 ��A��C����ͬһ���壬�������������8��Cԭ�Ӻ�������������A��Bԭ�Ӻ���������֮�ͣ���B��������Ϊ8��BΪOԪ�أ�Cԭ��������ϵĵ�������Dԭ��������������4������C����������Ϊ4��D������������Ϊ1�����AΪCԪ�أ�CΪSiԪ�أ�DΪNaԪ�أ��ݴ˽����⡣
��A��C����ͬһ���壬�������������8��Cԭ�Ӻ�������������A��Bԭ�Ӻ���������֮�ͣ���B��������Ϊ8��BΪOԪ�أ�Cԭ��������ϵĵ�������Dԭ��������������4������C����������Ϊ4��D������������Ϊ1�����AΪCԪ�أ�CΪSiԪ�أ�DΪNaԪ�أ��ݴ˽����⡣
(1)������ķ�����֪��AΪCԪ�أ�BΪOԪ�أ�CΪSiԪ�أ�DΪNaԪ�أ�������Ԫ�ص�Ԫ�����Ʒֱ���̼�������衢�ƣ�
(2)����Ԫ�����ڳ��³�ѹ����Һ̬����̬�⻯�����C��O��Si����Ӧ���⻯��Ļ�ѧʽΪCH4��H2O��SiH4������Ԫ�صķǽ�������ǿ������˳��Ϊ��O>C>Si��Ԫ�صķǽ�����Խǿ������Ӧ���⻯����ȶ��Ծ�Խǿ������⻯����ȶ���ΪH2O>CH4>SiH4��
(3)A��B�γɵ���ԭ�ӷ���ΪCO2��Cԭ���������4�����ӣ���2��Oԭ�ӵ�2���ɵ������γ�2�Թ��õ��Ӷԣ��Ӷ�ʹ������ÿ��ԭ�Ӷ��ﵽ8�����ӵ��ȶ��ṹ�������ʽ��![]() ��B��D�γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ΪNa2O2������ԭ���������6�����ӣ�2��Oԭ���γ�1�Թ��õ��Ӷԣ�ÿ��Oԭ���ٻ��1�����ӣ��Ӷ��γ�O22-��ÿ��ԭ�������8�����ӵ��ȶ��ṹ��Naԭ��ʧȥ������1�����ӣ�������Ϊ����㣬�γ�Na+���ﵽ8�����ӵ��ȶ��ṹ��Na+��O22-�γ����Ӽ������ĵ���ʽ��
��B��D�γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ΪNa2O2������ԭ���������6�����ӣ�2��Oԭ���γ�1�Թ��õ��Ӷԣ�ÿ��Oԭ���ٻ��1�����ӣ��Ӷ��γ�O22-��ÿ��ԭ�������8�����ӵ��ȶ��ṹ��Naԭ��ʧȥ������1�����ӣ�������Ϊ����㣬�γ�Na+���ﵽ8�����ӵ��ȶ��ṹ��Na+��O22-�γ����Ӽ������ĵ���ʽ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳ����������������������Ԫ���йص���
A.��ǿ������B.�ӵ�ʳ��C.�߽����D.�߸�ţ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪a��b��c��d���ֶ���������Ԫ�أ������ڱ������λ����ͼ������˵����ȷ����
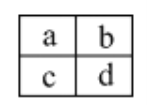
A. a��c��Ԫ�ص��������һ�����
B. ԭ�Ӱ뾶��С˳��Ϊ��c>d>b>a
C. a��b��Ԫ�ؿ����γɶ��ֹ��ۻ�����
D. c��d����Ԫ����̬�⻯����ȶ��ԱȽϣ�c > d
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������У�����ԭ�Ӷ����������Ϊ8���ӽṹ���ǣ� ��
A. H2O B. SF6 C. CCl4 D. PCl5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϡ����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2)�ڴ����������ºϳɼ״�����������Ҫ��Ӧ���£�
�� CO(g)��2H2(g)![]() CH3OH(g)�� ��H1 ����99kJ��mol��1
CH3OH(g)�� ��H1 ����99kJ��mol��1
�� CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H2����58 kJ��mol��1
CH3OH(g)��H2O(g) ��H2����58 kJ��mol��1
�� CO2(g)��H2(g)![]() CO(g)��H2O(g)�� ��H3
CO(g)��H2O(g)�� ��H3
��1��CO2�ĵ���ʽ��________________��
��2����H3��______kJ��mol��1���ڷ�Ӧ������ر䦤S______0(���������������)��
��3�����ݻ�Ϊ2 L���ܱ������У�����һ����CO2��H2�ϳɼ״�(�����ڷ�Ӧ)����������������ʱ���¶�T1��T2�Է�Ӧ��Ӱ��ͼ����ͼ��
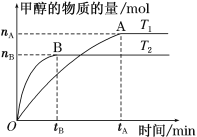
���¶�ΪT1ʱ���ӷ�Ӧ��ƽ�⣬���ɼ״���ƽ������Ϊv(CH3OH)��_____ mol��L��1��min��1��
��ͼʾ���¶�T1______T2����д��>������<����=����
��4��T1�¶�ʱ����2 mol CO2��6 mol H2����2 L�ܱ������У���ַ�Ӧ(�����ڷ�Ӧ)�ﵽƽ�����CO2ת����Ϊ50%����ʱ�����ڵ�ѹǿ����ʼѹǿ֮��Ϊ________����Ӧ���ڸ��¶ȴﵽƽ��ʱ����ƽ�ⳣ������ֵΪ_______��
��5������Ӧ����ԭ���������ʵ�֣���д�����������¶��Ե缫����CO2����CH3OH�ĵ缫��Ӧʽ��____________________,�õ缫Ϊԭ��ص�_______����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100 mL NaOH��Һ��ͨ��һ������CO2���壬��ַ�Ӧ������������Һ����μ���0.2 mol/L�����ᣬ����CO2������������������֮���ϵ����ͼ��ʾ�������ж���ȷ���ǣ� ��

A. ԭNaOH��Һ��Ũ��Ϊ0.1 mol��L��1
B. ͨ��CO2�����Ϊ448 mL
C. ������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaOH)��n(Na2CO3)��1��3
D. ������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaHCO3)��n(Na2CO3) �� 2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(AlN)��һ���������ǽ������ϡ�ijAlN��Ʒ������Al2O3���ʣ�Ϊ�ⶨAlN�ĺ����������������ʵ�鷽��(��֪��AlN��NaOH��H2O===NaAlO2��NH3��)��
������1��ȡһ��������Ʒ��������װ�òⶨ��Ʒ��AlN�Ĵ���(�г�װ������ȥ)��
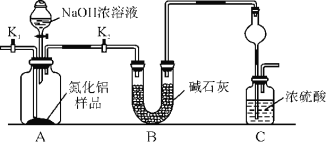
(1)��ͼCװ�������θ���ܵ�������_________��
(2)�������ʵ�鲽�裺��װ��ʵ��װ�ã����ȼ�������ԣ��ټ���ʵ��ҩƷ����������ʵ�������______________________����Һ©������������NaOHŨ��Һ�������ٲ������塣��K1��ͨ�뵪��һ��ʱ�䣬�ⶨCװ�÷�Ӧǰ��������仯��ͨ�뵪����Ŀ����______________________��
(3)����װ�ô���ȱ�ݣ����²ⶨ���ƫ�ߣ�������Ľ������_________________________��
������2������ͼװ�òⶨm g��Ʒ��AlN�Ĵ���(���ּг�װ������ȥ)��
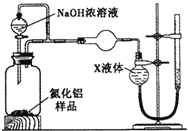
(4)Ϊ�ⶨ������������������װ���е�XҺ�������__________��
A��CCl4 B��H2O C��NH4Cl��Һ D����
������3�������²���ⶨ��Ʒ��AlN�Ĵ��ȣ�
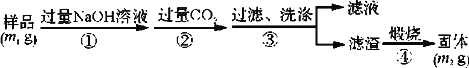
(5)��������ɳ��������ӷ���ʽΪ__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������һ���ܴ���������ǣ� ����
A. ��ǿ����Һ�У�Na+��K+��AlO2����CO32��
B. ��pH=0����Һ�У�K+��Fe2+��Cl����NO3��
C. �ں�����Fe3+����Һ�У�NH4+��Na+��Cl����SCN��
D. ��c��H+��=10��13mol/L����Һ�У�NH4+��Al3+��SO42����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ����Դ�����ǵ�ǰ����������ٵ�һ���ش���⡣
��1��ȼ�ϵ�ؽ�����ת��Ч�ʱ�ֱ��ȼ��Ч�ʸ�����ͼΪij��ȼ�ϵ�صĹ���ԭ��ʾ��ͼ��a��b��Ϊ���Ե缫��
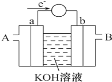
ʹ��ʱ��������_______��ͨ��(����A������B��);
��2�������ĸ�ʴ����dz��ձ����绯ѧ��ʴ����ɸ�����ʴ����Ҫԭ����ijͬѧ����ͼ���и�����ʴ��ģ�����������ĵ缫��ӦʽΪ:_________________������������3.01��1023����������������ʴ����Ԫ��Ϊ_______g��[ ��ʾ:�绯ѧ���ܷ�ӦʽΪ2Fe+2H2O+O2=2Fe(OH)2 ]
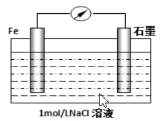
��3����ˮ��ѧ��Դ�Ŀ������þ�����Ҫ���������������ͼ�Ǻ�������ȡ���ʾ��ͼ:
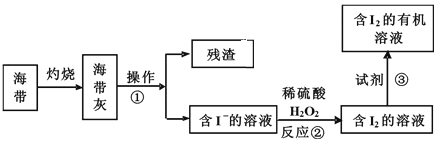
���в�����������_______�����������в������Լ��۵���________��
A.�Ҵ� B.�� C.���� D.���Ȼ�̼
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com