
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是________,D是________,G是________,H是________(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:_____________________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为__________________________。
(3)A中元素的原子结构示意图为________________。
(4)上述反应中属于氧化还原反应的是_________(填写序号)。
【答案】CO2 CaCl2 HClO O2 2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO ![]() ①⑤
①⑤
【解析】
反应①是重要的工业反应,工业上常利用反应①制取漂白粉,则A是Cl2,与石灰乳反应生成CaCl2和Ca(ClO)2,G在光照下反应,应为HClO,生成的气体H为O2,则F为HCl,B与澄清的石灰水反应产生E,E与HCl反应产生B与C反应产生G为HClO,所以C应为Ca(ClO)2,D为CaCl2,无色气体B应为CO2,沉淀E为CaCO3,以上推断符合题目转化关系,结合物质的性质和题目要求解答该题。
根据上述推断可知A是Cl2,B是CO2,C是Ca(ClO)2,D是CaCl2,E是CaCO3,F是HCl(盐酸),G是HClO,H是O2。
(1)由以上分析可知B是CO2,D为CaCl2,G为HClO,H为O2;
(2)反应①为Cl2和石灰乳Ca(OH)2的反应,生成CaCl2和Ca(ClO)2和H2O,反应的方程式为2Cl2+2Ca(OH)2=CaCl2+ Ca(ClO)2+2H2O,由于HClO的酸性比碳酸弱,所以漂白粉在空气中可发生Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
(3)A为Cl2,Cl元素是17号元素,原子核外有3个电子层,最外层电子数为7,原子结构示意图为![]() ;
;
(4)反应①⑤中,有元素化合价的变化,反应属于氧化还原反应,②③④反应中无元素化合价的变化,不属于氧化还原反应,故上述反应中属于氧化还原反应的是①⑤。


科目:高中化学 来源: 题型:
【题目】(题文)如图是元素周期表的一部分,回答下列问题: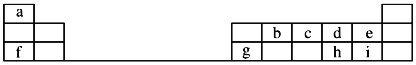
![]() 元素e的负一价离子的结构示意图为 ______ ,f、g、h、i对应简单离子的半径由大到小的顺序为 ______
元素e的负一价离子的结构示意图为 ______ ,f、g、h、i对应简单离子的半径由大到小的顺序为 ______ ![]() 用具体微粒符号表示
用具体微粒符号表示![]() .
.
![]() 元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为 ______ .
元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为 ______ .
![]() 、c、d三种原子的第一电离能大小顺为 ______
、c、d三种原子的第一电离能大小顺为 ______ ![]() 用具体微粒符号表示
用具体微粒符号表示![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于某些离子的检验及结论中一定正确的
A. 加入稀盐酸产生无色的气体,将气体通入澄清石灰水中,溶液变浑浊,一定有![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g)![]() CH3OH(g) ΔH1 =-99kJ·mol-1
CH3OH(g) ΔH1 =-99kJ·mol-1
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)CO2的电子式是________________。
(2)ΔH3=______kJ·mol-1,②反应正向的熵变ΔS______0(填“>”“<”或“=”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图。
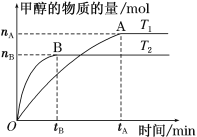
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=_____ mol·L-1·min-1。
②图示的温度T1______T2(填写“>”、“<”或“=”)
(4)T1温度时,将2 mol CO2和6 mol H2充入2 L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为________;反应②在该温度达到平衡时,其平衡常数的数值为_______。
(5)若反应②在原电池条件下实现,请写出酸性条件下惰性电极上由CO2生成CH3OH的电极反应式:____________________,该电极为原电池的_______极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,相关示意图错误的是( )
A | B | C | D |
将二氧化硫通入到一定量氯水中 | 将NaHCO3溶液滴入到一定量Ba(OH)2溶液中 | 将铜粉加入到一定量浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案(已知:AlN+NaOH+H2O===NaAlO2+NH3↑)。
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
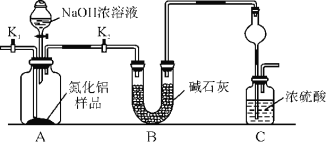
(1)上图C装置中球形干燥管的作用是_________。
(2)完成以下实验步骤:组装好实验装置,首先检查气密性,再加入实验药品,接下来的实验操作是______________________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见:_________________________。
(方案2)用下图装置测定m g样品中AlN的纯度(部分夹持装置已略去)。
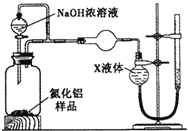
(4)为测定生成气体的体积,量气装置中的X液体可以是__________。
A.CCl4 B.H2O C.NH4Cl溶液 D.苯
(方案3)按以下步骤测定样品中AlN的纯度:
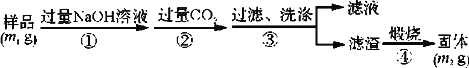
(5)步骤②生成沉淀的离子方程式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】党的十九大强调树立“社会主义生态文明观”。下列做法不应该提倡的是( )
A.研发可降解高分子材料,缓解白色污染问题
B.扩大铅蓄电池、含汞干电池的生产,满足消费需求
C.采用碳捕集和封存技术,逐步实现二氧化碳零排放
D.大力发展太阳能、风能等清洁能源,减少对化石燃料的依赖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是无色离子晶体,遇高热或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一。下列有关说法正确的是
A. NaN3中只含有离子键
B. 1 mol NaN3完全分解最多可以产生33.6L N2
C. 当有4.2g N2生成时,转移电子数约为6.02×1022
D. 常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是 ( )
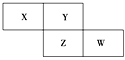
A. 原子半径:W>Z>XB. 非金属性:Z>Y
C. 最高化合价:X>ZD. 最高价氧化物对应水化物的酸性:W>Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com