
【题目】我国科学家屠呦呦因创造性地研制出抗疟新药青蒿素和双氢青蒿素(对疟原虫有100%的抑制率)而获2015年诺贝尔医学奖。如图为青蒿素的键线式,以下关于青蒿素的说法错误的是
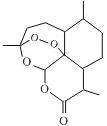
A. 含有酯基,可水解
B. 含有过氧键,有较强氧化性,且不够稳定
C. 青蒿素的化学式C15 H24O5
D. 在水中溶解度不大,易溶于有机溶剂
科目:高中化学 来源: 题型:
【题目】(题文)如图是元素周期表的一部分,回答下列问题: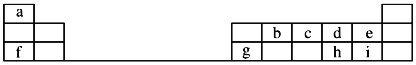
![]() 元素e的负一价离子的结构示意图为 ______ ,f、g、h、i对应简单离子的半径由大到小的顺序为 ______
元素e的负一价离子的结构示意图为 ______ ,f、g、h、i对应简单离子的半径由大到小的顺序为 ______ ![]() 用具体微粒符号表示
用具体微粒符号表示![]() .
.
![]() 元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为 ______ .
元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为 ______ .
![]() 、c、d三种原子的第一电离能大小顺为 ______
、c、d三种原子的第一电离能大小顺为 ______ ![]() 用具体微粒符号表示
用具体微粒符号表示![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关焰色反应的实验操作及注意事项正确的是( )
A.只有把盐配制成溶液才能进行焰色反应
B.实验时用铂丝直接蘸取药品在酒精灯上灼烧
C.可以用铁丝代替铂丝进行焰色反应
D.实验后要用稀硫酸将铂丝洗净
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃X(相对分子貭量为92)是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种高分子。

回答下列问题:
(1)B的名称是________,物质Y是乙酸吗_____(填“是”或 “不是”)?反应⑧属于____反应。H的含N官能团的名称是______。
(2)反应⑥、⑦两步能否互换____(填“能”或“不能”),理由是__________。
(3)上图中反应②的化学方程式是__________。
(4)比 相对分子质量大14的同系物M的同分异构体中,写出能同时满足以下条件的M(不考虑立体异构):_____________。
相对分子质量大14的同系物M的同分异构体中,写出能同时满足以下条件的M(不考虑立体异构):_____________。
①苯环上的一氯代物有2种,②能发生水解反应,③与FeCl3溶液能够发生显色反应。
(5)请用合成反应流程图表示出由![]() 和其他无机物合成
和其他无机物合成![]() 最合理的方案(不用写条件)__________。
最合理的方案(不用写条件)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a、b、c、d四种短周期主族元素,在周期表中相对位置如图,下列说法正确的是
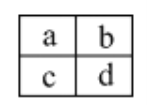
A. a、c两元素的最高正价一定相等
B. 原子半径大小顺序为:c>d>b>a
C. a、b两元素可能形成多种共价化合物
D. c、d二种元素气态氢化物的稳定性比较:c > d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于某些离子的检验及结论中一定正确的
A. 加入稀盐酸产生无色的气体,将气体通入澄清石灰水中,溶液变浑浊,一定有![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g)![]() CH3OH(g) ΔH1 =-99kJ·mol-1
CH3OH(g) ΔH1 =-99kJ·mol-1
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)CO2的电子式是________________。
(2)ΔH3=______kJ·mol-1,②反应正向的熵变ΔS______0(填“>”“<”或“=”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图。
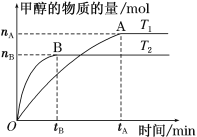
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=_____ mol·L-1·min-1。
②图示的温度T1______T2(填写“>”、“<”或“=”)
(4)T1温度时,将2 mol CO2和6 mol H2充入2 L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为________;反应②在该温度达到平衡时,其平衡常数的数值为_______。
(5)若反应②在原电池条件下实现,请写出酸性条件下惰性电极上由CO2生成CH3OH的电极反应式:____________________,该电极为原电池的_______极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是无色离子晶体,遇高热或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一。下列有关说法正确的是
A. NaN3中只含有离子键
B. 1 mol NaN3完全分解最多可以产生33.6L N2
C. 当有4.2g N2生成时,转移电子数约为6.02×1022
D. 常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com