
分析 (1)依据题干数据计算沉淀后溶液中氯离子浓度,结合Ksp计算溶液中银离子浓度;
(2)沉淀后溶液中剩余氢离子浓度,计算pH.
解答 解:(1)向50ml0.018mol/L的AgNO3溶液中加入50ml0.02mol/L的盐酸,混合后两者浓度分别为c(Ag+)=$\frac{0.018}{2}$mol/L=0.009 mol/L、c(Cl-)=$\frac{0.02}{2}$mol/L=0.01mol/L,Ag+与Cl-是等物质的量反应的,此时Cl-过量,过量浓度c(Cl-)=0.01mol/L-0.009mol/L=0.001mol/L,
Ksp=c(Ag+)×C(Cl-)=1.0×10-10,则:c(Ag+)=$\frac{1.0×1{0}^{-10}}{0.001}$mol/L=1.0×10-7mol/L,
故答案为:1.0×10-7mol/L;
(2)沉淀生成后,氢离子浓度c=$\frac{0.02mol/L}{2}$=0.01mol/L,所以pH=2,
故答案为:2.
点评 本题考查溶液浓度的计算,侧重于学生的分析、计算能力的考查,为高频考点,本题难度不大,做题时注意判断两种物质的反应程度,再根据溶度积常数计算.


科目:高中化学 来源: 题型:解答题
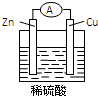 Zn-Cu-H2SO4原电池的负极材料是Zn,正极反应式是2H++2e-═H2↑,发生还原反应反应(填反应类型),总反应式为Zn+H2SO4═ZnSO4+H2↑.
Zn-Cu-H2SO4原电池的负极材料是Zn,正极反应式是2H++2e-═H2↑,发生还原反应反应(填反应类型),总反应式为Zn+H2SO4═ZnSO4+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中C、H、O个数之比为1:2:3 | B. | 分子中C、H个数之比为1:4 | ||
| C. | 分子中可能含有氧原子 | D. | 此有机物的最简式为CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积(Ksp) | 2.2×10-20 | 8.0×10-15 | 4.0×10-38 |
| 完全沉淀时的pH | ≥5.0 | ≥5.5 | ≥4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
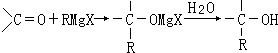

 ,
,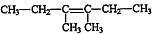 ;
;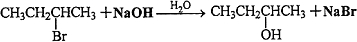 ,I→J
,I→J .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量的碳酸钠固体 | B. | 通入CO2 | ||
| C. | 加入少量盐酸 | D. | 加入少量氢氧化钙固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用电解的方法可以从海水中获取淡水 | |
| B. | 海水蒸发制海盐的过程只发生了化学变化 | |
| C. | 海水中含有钾元素,只需经过物理变化可以得到钾单质 | |
| D. | 从海水中可以得到NaCl,电解熔融NaCl可制备Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | Fe2O3 | SiO2 | NaOH | 过滤 |
| B | CO2 | CO | O2 | 点燃 |
| C | FeCl2溶液 | FeCl3 | Cu | 分液 |
| D | CH3CH2OH | H2O | Na | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com