
【题目】可逆反应aA(g)+bB(g)cC(g)+dD(g);△H同时符合下列两图中各曲线的规律的是( ) 
A.a+b>c+d T1<T2△H<0
B.a+b>c+d T1<T2△H>0
C.a+b<c+d T1>T2△H<0
D.a+b>c+d T1>T2△H>0
【答案】A
【解析】解:由左图可知,T2时到达平衡的时间短,则速率快,所以T1<T2 , 升高温度生成物浓度降低,说明平衡向逆反应方向移动,则正反应放热,△H<0;
由右图可知,增大压强,正反应速率大于逆反应速率,平衡向正反应方向移动,则a+b>c+d;
故选A.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)).


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的混合气体X和铜跟浓硝酸反应产生的混合气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )

A. 洗气瓶中产生的沉淀是BaCO3
B. 在Z导管出来的气体中无CO2
C. 洗气瓶中产生的沉淀是BaSO3
D. 在Z导管口有红棕色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填空
(1)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.已知:SeO2在常温下是白色的晶体,熔点为340﹣350℃,则SeO2晶体属于晶体,SeO2中Se原子采取的杂化类型为
(2)卤素单质及其化合物在工农业生产和生活中都有重要的用途.
①同主族元素的电负性大小存在一定的规律,卤族元素(F、Cl、Br、I)中,电负性最小的是 , 基态Br原子的价电子排布为 .
②硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3NH3 . BF3分子的分子构型为 , BF3NH3中BF3与NH3之间通过结合(填“离子键”、“配位键”或“氢键”).
(3)某金属是抗癌药物中的明星元素,其晶体中金属原子的堆积方式如图所示.该晶胞中金属原子的配位数为 , 若已知金属的摩尔质量为Mg/mol,原子半径为rpm,阿伏加德罗常数为NA , 则该晶胞的密度为g/cm3 . (用含M、NA、则的代数式表示,1pm=1.0X10﹣10cm) 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】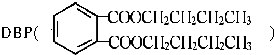 是一种常见的塑化剂,
是一种常见的塑化剂,
可由乙烯和邻二甲苯合成.
已知: 
DBP的合成过程如下: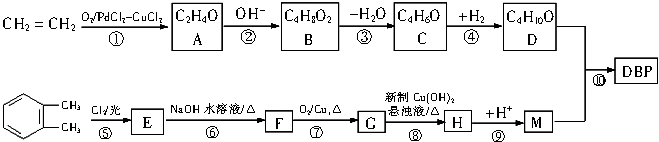
(1)D中含有的官能团名称是 , M的分子式是 .
(2)写出反应类型:反应③;反应(5) .
(3)写出结构简式A、 F .
(4)化合物B有多种同分异构体,如果这种同分异构体能与NaHCO3溶液反应生成气体,在核磁共振氢谱中只有3处吸收峰,写出其结构简式 .
(5)写出反应⑧、⑩的化学方程式
⑧
⑩ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①海带等藻类物质经过处理后,可以得到碘水,向碘水中加入四氯化碳以提取碘单质的实验操作叫________,该操作需要的玻璃仪器有________。
②某NaCl样品中可能含有SO42-,CO32-,为检验杂质离子的存在,采取如下实验步骤:样品![]() 无明显现象
无明显现象![]() 无明显现象。则加入的试剂A为_______,B为_______,该现象证明样品中不含有____。
无明显现象。则加入的试剂A为_______,B为_______,该现象证明样品中不含有____。
③在后续实验中需要使用450mL0.5 mol·L- 1NaCl溶液,为配制该浓度NaCl溶液进行实验,需用托盘天平称取NaCl_______g。配制NaCl溶液时,若出现下列操作,会使配制浓度偏高的是(_____)
A.天平砝码己锈蚀 B.配制过程中未用蒸馏水洗涤烧杯和玻璃棒
C.转移溶液时有溶液溅出 D.定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是﹣285.8kJmlo﹣1﹣1411.0kJmlo﹣1和﹣1366.8kJmlo﹣1 , 则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A.﹣44.2kJmol﹣1
B.+44.2kJmol﹣1
C.﹣330kJmol﹣1
D.+330kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素.
回答下列问题:
(1)L的元素符号为;M在元素周期表中的位置为;五种元素的原子半径从大到小的顺序是(用元素符号表示).
(2)Z、X两元素按原子数目比l:3和2:4构成分子A和B,A的电子式为 , B的结构式为 .
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为 , 其最高价氧化物对应的水化物化学式为 . 该族2~5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是(填字母代号).
a.+99.7molL﹣1 b.+29.7molL﹣1 c.﹣20.6molL﹣1 d.﹣241.8kJmol﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol.
A.①②③
B.①②⑤
C.①②⑤⑥
D.②④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com