
����Ŀ��������ѧ֪ʶ���
��1���ء��������Ԫ�صĻ�����������������̫���ܵ�ص���Ҫ���ϣ���֪��SeO2�ڳ������ǰ�ɫ�ľ��壬�۵�Ϊ340��350�棬��SeO2�����������壬SeO2��Seԭ�Ӳ�ȡ���ӻ�����Ϊ
��2��±�ص��ʼ��仯�����ڹ�ũҵ�����������ж�����Ҫ����;��
��ͬ����Ԫ�صĵ縺�Դ�С����һ���Ĺ��ɣ�±��Ԫ�أ�F��Cl��Br��I���У��縺����С���� �� ��̬Brԭ�ӵļ۵����Ų�Ϊ ��
����Ԫ�ؾ���ȱ�����ԣ��۵��������ڼ۲����������仯���������й¶Ե��ӵķ��ӻ���������������BF3����NH3��Ӧ����BF3NH3 �� BF3���ӵķ��ӹ���Ϊ �� BF3NH3��BF3��NH3֮��ͨ�����������Ӽ���������λ���������������
��3��ij�����ǿ���ҩ���е�����Ԫ�أ��侧���н���ԭ�ӵĶѻ���ʽ��ͼ��ʾ���þ����н���ԭ�ӵ���λ��Ϊ �� ����֪������Ħ������ΪMg/mol��ԭ�Ӱ뾶Ϊrpm�������ӵ�����ΪNA �� ��þ������ܶ�Ϊg/cm3 �� ���ú�M��NA����Ĵ���ʽ��ʾ��1pm=1.0X10��10cm�� 
���𰸡�
��1�����Ӿ��壻sp2�ӻ�
��2��I��4s24p5��ƽ���������Σ���λ��
��3��12
���������⣺��1��SeO2�����°�ɫ���壬�۵�Ϊ340��350�棬�۵�ͣ�Ϊ���Ӿ��壻SeO2������Seԭ�Ӽ۲���Ӷ�=2+ ![]() ��6��2��2��=3��Seԭ�ӵ��ӻ�����Ϊsp2�ӻ���
��6��2��2��=3��Seԭ�ӵ��ӻ�����Ϊsp2�ӻ���
���Դ��ǣ����Ӿ��壻sp2�ӻ�����2����ͬ�������϶��µ縺�Լ�С����F�ĵ縺�����I�ĵ縺����С��Brԭ�ӵĺ�������Ų�ʽΪ��[Ar]3d104s24p5 �� �����7������Ϊ�۵��ӣ����Ի�̬Brԭ�ӵļ۵����Ų�Ϊ4s24p5 ��
���Դ��ǣ�I��4s24p5�� ��BF3�����м۲���ӶԸ���=3+ ![]() ����3��3��1��=3�Ҳ����µ��Ӷԣ����Ը÷�����ƽ�������νṹ��������BF3NH3�У�Bԭ���ṩ�չ����ԭ�ӡ�Nԭ���ṩ�µ��Ӷԣ�����B��Nԭ��֮���γ���λ����
����3��3��1��=3�Ҳ����µ��Ӷԣ����Ը÷�����ƽ�������νṹ��������BF3NH3�У�Bԭ���ṩ�չ����ԭ�ӡ�Nԭ���ṩ�µ��Ӷԣ�����B��Nԭ��֮���γ���λ����
���Դ��ǣ�ƽ���������Σ���λ������3���ɾ���ͼ��֪���þ�����ԭ�ӵĶѻ���ʽΪ�����������ܶѻ�������λ��Ϊ12������߳�Ϊacm����a2+a2=��4r��10��10��2 �� V=a3=��2 ![]() r��10��10��3 �� ������ԭ����Ϊ
r��10��10��3 �� ������ԭ����Ϊ ![]() ��6+
��6+ ![]() ��8=4������������Ϊm=
��8=4������������Ϊm= ![]() �����Ԧ�=
�����Ԧ�= ![]() =
= 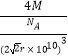 ��
��
���Դ��ǣ�12��  ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���ܹ�˵�����ķǽ����Ա���ǿ����
A.HNO3��H3PO4���ȶ�B.HNO3�������Ա�H3PO4ǿ
C.HNO3�����Ա�H3PO4ǿD.HNO3��H3PO4���ӷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�����ʵ���Ũ�ȵ�ij��Һ�����������ʹ���ƽ��ƫ�͵���(����)
A. δ��ȴ��ת�ơ�����
B. δϴ���ձ���������
C. ����ʱ���ӿ̶��߹۲�Һ��
D. ����ƿ��ԭ����������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��Ҫ����0.1molL��1 ��NaHCO3��Һ500mL���������Һ���ƹ����е�����ش��������⣺
��1��NaHCO3���׳�__������0.1molL��1 ��NaHCO3��Һʱ��Ӧ��ȡ����NaHCO3������Ϊ__��
��2��ʵ���г���������ƽ������������ӣ����ձ���ҩ�ס����������Ҫ������������__�����������õ��������������÷ֱ���__��
��3�����ݹ۲�Һ��ʱ���ӿ̶��ߣ�������ҺŨ��__������ƫ��������ƫ����������Ӱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г�ȥ���ʣ����ŵ�����Ϊ���ʣ��ķ����У�������ǣ� ��
A.FeCl3��Һ��FeCl2����ͨ������Cl2
B.CO��CO2����ͨ��NaOH��Һϴ�������
C.MnO2��KCl������ˮ�ܽ����ˡ�ϴ�ӡ����
D.SO2��HCl����ͨ������Na2CO3��Һϴ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�����CO��CO2��Ƚϣ������й���������ȷ���ǣ� ����
�����������ķ�����Ŀ֮��Ϊ1��1����������������Oԭ����Ŀ֮��Ϊ1��2����������������ԭ������Ŀ֮��Ϊ2��3����������������Cԭ����Ŀ֮��Ϊ1��1�������������ĵ�����Ŀ֮��Ϊ7��11
A. �٢ڢۢ�B. �ں͢�C. �ܺ͢�D. �٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦaA��g��+bB��g��cC��g��+dD��g������Hͬʱ����������ͼ�и����ߵĹ��ɵ��ǣ� �� 
A.a+b��c+d T1��T2��H��0
B.a+b��c+d T1��T2��H��0
C.a+b��c+d T1��T2��H��0
D.a+b��c+d T1��T2��H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������ֵ������˵����ȷ������
A. ͬ��ͬѹ����3molO2��2molO3�����ǵ��ܶȱ�Ϊ 1:1
B. 46 ��NO2��N2O4 �Ļ������ԭ�Ӹ���Ϊ3NA
C. ����7.1gCl2 ת�Ƶ�����ĿΪ0.2NA
D. ��״������11.2LSO3������ԭ�Ӹ���Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ���;������ǣ� ��
A.��������̫���ܵ�صij��ò���
B.�����������������IJ���
C.ˮ����������ľ�ķ����
D.�������������ɰֽ��ɰ�ֵ�ĥ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com