
����Ŀ��úȼ���ŷŵ������к���SO2�����γ����ꡢ��Ⱦ��������Чȥ��������SO2�ǻ�����������Ҫ���⡣
��1��˫�ϴ��SO2��NaOH��Һ![]() Na2SO3��Һ
Na2SO3��Һ
��������������Na2SO3�����ӷ���ʽΪ_________��
��˫�ϴ��SO2���ŵ�Ϊ_________��
��2��NaClO2����������SO2����NaClO2��Һ��ͨ�뺬��SO2����������Ӧ�¶�Ϊ323 K����Ӧһ��ʱ�䡣
���������շ�Ӧ�Ľ��У����ռ���Һ��pH��_________����������䡱��С������
���������NaClO���NaClO2��Ҳ�ܵõ��Ϻõ���������Ч�������յ�����SO2������NaClO�����ʵ�����NaClO2��_________����
��3��SO2�����á���������������(Na2S2O5)��ͨ������NaHSO3��������Һ���ᾧ��ˮ�Ƶá������̵����е�SO2����Na2S2O5�Ĺ������£�
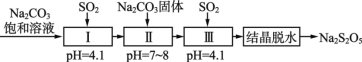
�٢��з�Ӧ�Ļ�ѧ����ʽΪ___________��
��������ͨ��SO2���㣬�ᾧ��ˮ�õ���Na2S2O5�л��е���Ҫ������_______���ѧʽ����
�۹����м���Na2CO3���壬���ٴγ���SO2��Ŀ����_________��
���𰸡�2OH����SO2=SO32-��H2O ��CaO��ʹNaOH���� ��С 2 Na2CO3+2SO2+H2O=2NaHSO3+CO2 Na2SO3 �õ�NaHSO3��������Һ
��������
��1����SO2��NaOH��Ӧ������Na2SO3��H2O���ݴ�д�����ӷ���ʽ��
��˫�ϴ��SO2���ŵ�ΪCaO��ʹNaOH������
��2�������ռ���Һ�����ķ�ӦΪClO2-+2SO2+2H2O=Cl-+2SO42-+4H+����Ӧ���������ӣ�������Һ��pH��С��
�ڸ���ClO2-+2SO2+2H2O=Cl-+2SO42-+4H+��ClO-+SO2+H2O=Cl-+SO42-+2H+���з�����
��3���٢��У�pH=4.1��˵����Ӧ�����������ʣ�ֻ��ΪNaHSO3���ݴ�����д����ѧ����ʽ��
��������ͨ��SO2���㣬����ҺΪNa2SO3��NaHSO3�Ļ����ᾧ��ˮ�õ���Na2S2O5�л��е���Ҫ������Na2SO3��
��ͨ�������Ϣ��֪����������������(Na2S2O5)��ͨ������NaHSO3��������Һ���ᾧ��ˮ�Ƶá����ݴ˽��з�����
��1����SO2��NaOH��Ӧ������Na2SO3��H2O����Ӧ�����ӷ���ʽΪ2OH����SO2=SO32-��H2O��
����2OH����SO2=SO32-��H2O��
��˫�ϴ��SO2���ŵ�ΪCaO��ʹNaOH������
��Ϊ��CaO��ʹNaOH������
��2�����������շ�Ӧ�Ľ��У����ռ���Һ�����ķ�ӦΪClO2-+2SO2+2H2O=Cl-+2SO42-+4H+��������Һ��pH��С��
��Ϊ����С��
���������NaClO���NaClO2����Ӧ�����ӷ���ʽΪClO-+SO2+H2O=Cl-+SO42-+2H+������ClO2-+2SO2+2H2O=Cl-+2SO42-+4H+��Ӧ��֪�����յ�����SO2������NaClO�����ʵ�����NaClO2��2����
����2��
��3���٢��У�pH=4.1��˵����Ӧ�����������ʣ�ֻ��ΪNaHSO3����Ӧ�Ļ�ѧ����ʽΪNa2CO3+2SO2+H2O=2NaHSO3+CO2��
����Na2CO3+2SO2+H2O=2NaHSO3+CO2 ��
��������ͨ��SO2���㣬����ҺΪNa2SO3��NaHSO3�Ļ����ᾧ��ˮ�õ���Na2S2O5�л��е���Ҫ������Na2SO3��
����Na2SO3��
�������Ϣ�������ǡ���������������(Na2S2O5)��ͨ������NaHSO3��������Һ���ᾧ��ˮ�Ƶá��������м���Na2CO3���壬���ٴγ���SO2��Ŀ�ģ���Ȼ��Ϊ�����ջ��NaHSO3��������Һ��
�ʴ�Ϊ���õ�NaHSO3��������Һ��


 ��һ������Ԫͬ�����ؾ�ϵ�д�
��һ������Ԫͬ�����ؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������õ�Ũ�ȵ�NaOH��Һ�ζ�25.00mL0.1000mol��L-1H2C2O4��Һ���յ㡣�ζ����̵õ���������Һ���������ʵ���Ũ�ȹ�ϵ��ȷ���ǣ� ��
��֪����Ka1(H2C2O4)=5.4��10-2 Ka2(H2C2O4)=5.4��10-5
����H2C2O4��Һ��c(��)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
A.����NaOH��Һ���Ϊ25.00mLʱ��c(Na+)>c(H2C2O4)>c(C2O42-)>c(H+)
B.pH=7����Һ��c(Na+)=c(C2O42-)+c(HC2O4-)
C.��c(Na+)=2c(��)ʱ��c(OH-)=c(H+)+c((HC2O4-)+c(H2C2O4)
D.0.1000mol��L-1H2C2O4��Һ��c(H+)=0.1000mol��L-1+c(C2O42-)+c(OH-)-c(H2C2O4)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£���NH3����ͨ�뱥��ʳ��ˮ�������ͣ�Ȼ����������Һ�л���ͨ��CO2������ʵ���������Һ��pH��ͨ����������ı仯������ͼ��ʾ��ʵ���в����ǰ�ˮ�Ļӷ�����������������ȷ����
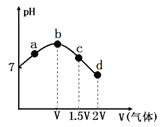
A.��a�㵽b��Ĺ����У���Һ�� ����
����
B.��ͼ��֪(NH4)2CO3��Һ�Լ��ԡ�NH4Cl��Һ������
C.c����ʾ��Һ�У�c(NH4+)��c(CO32-)��c(OH-)��c(H+)
D.d����ʾ��Һ�У�c(NH4+)+c(NH3��H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������зḻ��ʳƷ���������Դ��ҩ���ˮ����Դ����ͼΪ��ˮ���õIJ��ֹ��̡������й�˵������ȷ����
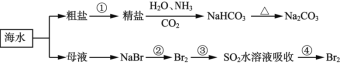
A.��ȡNaHCO3�ķ�Ӧ���������ܽ��С��NaCl
B.�����Ƽ�Ӧ��ͨNH3��ͨCO2
C.�ڵ����������������У���Ԫ�ؾ�������
D.�ۢ���Ŀ���ǽ�����ĸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧʵ�����������ͽ��۾�Ϊ��ȷ����
ѡ�� | ���� | ���� | ���� |
A | Mg2+��Cu2+�������Һ�е�������NaOH��Һ | ������ɫ���� | ��ͬ�¶��£��ܶȻ����� Ksp��Mg(OH)2�ݣ�Ksp��Cu(OH)2�� |
B | ����ʢ��(NH4)2CO3������Թܣ������Թܿڷ���ʪ��ĺ�ɫʯ����ֽ | ��ֽ���� | (NH4)2CO3�Լ��� |
C | �����£����Ũ�ȡ��������Na2CO3��NaHCO3��Һ�еμӵ����ķ�̪��Һ | ̼������Һ�к�ɫ���� | ������ˮ�ⳣ��Kh: CO32-��HCO3- |
D | ��������Һ�еμ�����Na2CO3��ĩ | ������ð�� | ����֤������:̼����� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��H2��һ�������ºϳɼ״��ķ�ӦΪ��CO(g)+2H2(g)![]() CH3OH(g) ��H1�������ݻ���Ϊ1L��a��b��c��d��e����ܱ������зֱ����1molCO��2molH2�Ļ�����壬�����¶ȣ�����ʵ�飬������������ͼ��ͼ1���¶ȷֱ�Ϊ300�� ��500����ܱ������У��״������ʵ�����ͼ2���¶ȷֱ�ΪTl��T5���ܱ������У���Ӧ�����е�5minʱ�״������������������������ȷ����
CH3OH(g) ��H1�������ݻ���Ϊ1L��a��b��c��d��e����ܱ������зֱ����1molCO��2molH2�Ļ�����壬�����¶ȣ�����ʵ�飬������������ͼ��ͼ1���¶ȷֱ�Ϊ300�� ��500����ܱ������У��״������ʵ�����ͼ2���¶ȷֱ�ΪTl��T5���ܱ������У���Ӧ�����е�5minʱ�״������������������������ȷ����

A. �÷�Ӧ�ġ�H1>0����K1>K2
B. ������c�е�ƽ��״̬ת�䵽����d�е�ƽ��״̬,�ɲ�ȡ�Ĵ�ʩ�����»��ѹ
C. 300��ʱ����ƽ�����������ٳ���0.8molCO, 0.6molH2��0.2molCH3OH��ƽ�������ƶ�
D. 500��ʱ����ƽ�����������ٳ���1molCH3OH������ƽ���H2Ũ�ȺͰٷֺ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ����Ҫ�Ļ���ԭ�ϣ���������������Ҫ��Ӧ��
(1)CH3OH(g)��CO(g)HCOOCH3(g)��H����29.1kJ��mol-1������Ա�Ը÷�Ӧ�������о��������о��������:

�ٴӷ�Ӧѹǿ�Լ״�ת���ʵ�Ӱ�조Ч�ʿ�����ҵ��ȡ�������Ӧѡ���ѹǿ��__________(�3.5��106Pa������4.0��106Pa����5.0��106Pa��)
��ʵ�ʹ�ҵ�����в��õ��¶���80�棬��������________________________________________
(2)ֱ�Ӽ״�ȼ�ϵ��(���DMFC)������ṹ������ת���ʸߡ��Ի�������Ⱦ������Ϊ������Դ�����Ʒ��Խ��Խ�ܵ���ע��DMFC�Ĺ���ԭ����ͼ3��ʾ:
��ͨ��a����ĵ缫�ǵ�ص�__________(���������)������缫��ӦʽΪ__________
�ڳ����£��ô˵�����Ե缫���0.5L����ʳ��ˮ(����)������������������1.12L(������Ϊ��״���µ����)���������Һ��pHΪ__________(������Һ������仯)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȷ�![]() ���治�����������������綾�����
���治�����������������綾�����![]() ��
��![]() ������˵������ȷ����
������˵������ȷ����![]() ����
����![]()

A. ![]() ����Ϊ�����Լ��ķǼ��Է���
����Ϊ�����Լ��ķǼ��Է���
B. ![]() �������3��
�����к���3��![]() ����һ��
����һ��![]() ��������Cԭ�Ӳ���
��������Cԭ�Ӳ���![]() �ӻ�
�ӻ�
C. ![]() ����������ԭ�ӵ��������Ӷ�����8�����ȶ��ṹ
����������ԭ�ӵ��������Ӷ�����8�����ȶ��ṹ
D. ʹ��ǰ����������ϡ��Һ�����ȷ��Ƿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� 20 ��ʱ��ij��̬����������ϣ�װ���ܱ������У���ȼ��ը���ָֻ��� 20 �棬 ��ʱ�����������ѹǿΪ��Ӧǰ��һ�룬�� NaOH ��Һ���պ������ڼ�������գ��� ���ķ���ʽ������( )
A.CH4B.C2H6C.C3H6D.C3H8
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com