
【题目】室温下用等浓度的NaOH溶液滴定25.00mL0.1000mol·L-1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系正确的是( )
已知:①Ka1(H2C2O4)=5.4×10-2 Ka2(H2C2O4)=5.4×10-5
②设H2C2O4溶液中c(总)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
A.滴入NaOH溶液体积为25.00mL时:c(Na+)>c(H2C2O4)>c(C2O42-)>c(H+)
B.pH=7的溶液:c(Na+)=c(C2O42-)+c(HC2O4-)
C.当c(Na+)=2c(总)时:c(OH-)=c(H+)+c((HC2O4-)+c(H2C2O4)
D.0.1000mol·L-1H2C2O4溶液:c(H+)=0.1000mol·L-1+c(C2O42-)+c(OH-)-c(H2C2O4)
【答案】D
【解析】
因为Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,所以H2C2O4是二元弱酸,NaOH是一元强碱,所以等浓度的NaOH溶液滴定25.00mL0.1000mol·L-1H2C2O4溶液,消耗25mL H2C2O4时溶质为NaHC2O4,消耗50mL H2C2O4时溶质为Na2C2O4,据此分析回答。
A.滴入NaOH溶液体积为25.00mL时,NaOH和草酸按1:1反应,溶质为NaHC2O4,HC2O4-既会水解,又会电离,水解为:HC2O4-+H2O![]() H2C2O4+OH-,根据Kh×Ka=Kw得:HC2O4-的水解常数Kh=
H2C2O4+OH-,根据Kh×Ka=Kw得:HC2O4-的水解常数Kh=![]() =1.85×10-13,电离为:HC2O4-
=1.85×10-13,电离为:HC2O4-![]() C2O42-+H+,其电离常数Ka= Ka2(H2C2O4)=5.4×10-5,所以电离常数Ka>水解常数Kh,故此时溶液显酸性且c(C2O42-)> c(H2C2O4),A错误;
C2O42-+H+,其电离常数Ka= Ka2(H2C2O4)=5.4×10-5,所以电离常数Ka>水解常数Kh,故此时溶液显酸性且c(C2O42-)> c(H2C2O4),A错误;
B.根据电荷守恒有:c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-),pH=7时,有:c(H+)= c(OH-),所以c(Na+)=2c(C2O42-)+c(HC2O4-),B错误;
C.c(Na+)=2c(总)=2[c(H2C2O4)+c(HC2O4-)+c(C2O42-)],是Na2C2O4溶液的物料守恒,即此时溶质为Na2C2O4,Na2C2O4溶液的质子守恒为:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),C错误;
D.0.1000mol·L-1H2C2O4溶液电荷守恒式子为:c(H+)=2 c(C2O42-)+ c(HC2O4-)+c(OH-),物料守恒式子为:0.1000mol·L-1= c(H2C2O4)+ c(C2O42-)+ c(HC2O4-),用电荷守恒式子-物料守恒式子得:c(H+)=0.1000mol·L-1+c(C2O42-)+c(OH-)-c(H2C2O4),D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】HCHO与O2在羟基磷灰石(HAP)表面反应通过两步反应生成CO2、H2O的机理如图所示(图中只给出了HAP的部分结构)。下列说法错误的是( )
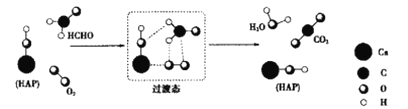
A.HCHO在反应过程中,所有C-H键都发生断裂
B.反应第一步是吸热过程
C.产物H2O中的O全部来自于O2
D.HAP是该反应的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G 为短周期主族元素,其原子半径与最外层电子数的关系如图,下列说法正确的是
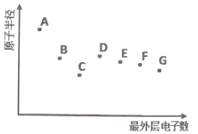
A.根据元素B 在元素周期表中的位置推测,其最高价氧化物对应的水化物可能具有两性
B.元素D在自然界中主要以游离态存在,其单质可用作半导体材料
C.元素A的离子半径大于元素G的离子半径
D.元素F 的气态氢化物比元素G的气态氢化物更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一包铝粉和铜粉的混合物,用100mL 某浓度的稀硝酸溶解,生成的气体全部是NO, 待粉末完全溶解后,逐滴加入3molL-1 的氨水,产生沉淀的物质的量与加入氨水的体积关系如图。
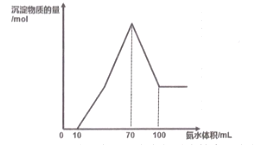
(1)写出图中滴加氨水10~100mL 的过程中铜元素参与反应的离子方程式_________。
(2)所用硝酸的物质的量浓度为______mol L-1;写出简要计算过程______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图(1)是实验室合成溴苯并检验其部分生成物的装置,下列说法错误的是( )
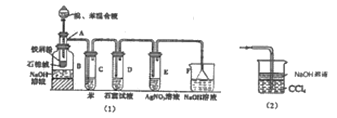
A.苯和液溴在A中发生反应的化学方程式为:![]() +Br2
+Br2 +HBr
+HBr
B.实验中C中的液体逐渐变为浅红色,是因为溴具有挥发性
C.D、E、F均具有防倒吸的作用,其中F不可以用图(2)所示装置代替
D.D中石蕊试液慢慢变红,E中产生浅黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉在一定条件下发生下列转化关系:

已知:化合物H中含有一个甲基。请回答:
(1)写出B的电子式___;化合物D中的官能团名称___。
(2)E+H→G的化学方程式:___。
(3)下列说法不正确的是___。
A.化合物A和D能与银氨溶液反应生成光亮的银镜
B.用新制的氢氧化铜不能区分化合物C、D、E
C.相同质量的A、E和H充分燃烧时消耗等量的氧气
D.化合物F与G互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是一种相对分子质量为92的芳香烃,以X为原料制备部分有机物的路线如下:
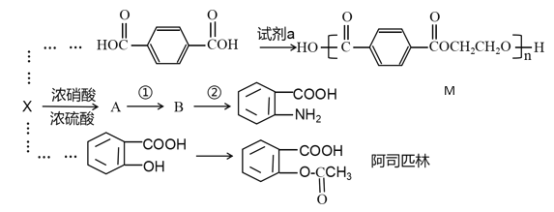
已知:![]()
(1)第①步和第②步顺序不能互换的原因_____。
(2)写出X到A的反应方程式__________________________。
(3)A到B所用试剂___________。
(4)由X制备A时,简述配制混酸的方法____________________。
(5)试剂a___________(结构简式)。
(6)M为涤纶,是一种高分子聚合物,有关M的说法正确的是___。
A.M其中一种单体对苯二甲酸和苯甲酸互为同系物
B.1mol 该物质与氢氧化钠溶液反应,理论上最多可以消耗2n mol NaOH
C.生成该聚合物的反应属于加聚反应
D.涤纶是对苯二甲酸和乙醇通过缩聚反应得到
(7)写出同时满足条件的阿司匹林的同分异构体结构简式________________。
①含有苯环且水解产物能与FeCl3溶液发生显色反应
②能发生银镜反应
③核磁共振氢谱为4组峰,且峰面积之比为1:2:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气中含有SO2,易形成酸雨、污染大气。有效去除和利用SO2是环境保护的重要议题。
(1)双碱法洗除SO2。NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
①上述过程生成Na2SO3的离子方程式为_________。
②双碱法洗除SO2的优点为_________。
(2)NaClO2氧化法吸收SO2。向NaClO2溶液中通入含有SO2的烟气,反应温度为323 K,反应一段时间。
①随着吸收反应的进行,吸收剂溶液的pH逐渐_________(填“增大”“不变”或“减小”)。
②如果采用NaClO替代NaClO2,也能得到较好的烟气脱硫效果。吸收等量的SO2,所需NaClO的物质的量是NaClO2的_________倍。
(3)SO2的利用。生产焦亚硫酸钠(Na2S2O5),通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺如下:
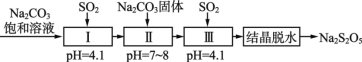
①Ⅰ中反应的化学方程式为___________。
②若Ⅲ中通入SO2不足,结晶脱水得到的Na2S2O5中混有的主要杂质是_______(填化学式)。
③工艺中加入Na2CO3固体,并再次充入SO2的目的是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com