
【题目】现有一包铝粉和铜粉的混合物,用100mL 某浓度的稀硝酸溶解,生成的气体全部是NO, 待粉末完全溶解后,逐滴加入3molL-1 的氨水,产生沉淀的物质的量与加入氨水的体积关系如图。
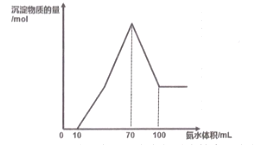
(1)写出图中滴加氨水10~100mL 的过程中铜元素参与反应的离子方程式_________。
(2)所用硝酸的物质的量浓度为______mol L-1;写出简要计算过程______。
【答案】Cu2++2NH3·H2O=Cu(OH)2↓+2![]() ,Cu(OH)2+4
,Cu(OH)2+4![]() =
=![]() +2OH-+4H2O 2.7 过程:根据沉淀所用氨水0.18mol,得显酸性的硝酸根为 0.03mol; 根据稀硝酸和金属反应的关系,求得硝酸的物质的量为 0.03+
+2OH-+4H2O 2.7 过程:根据沉淀所用氨水0.18mol,得显酸性的硝酸根为 0.03mol; 根据稀硝酸和金属反应的关系,求得硝酸的物质的量为 0.03+![]() ×0.18mol=0.27mol。
×0.18mol=0.27mol。
【解析】
铝粉和铜粉的混合物,用100mL 某浓度的稀硝酸完全溶解,得到含有铝离子和铜离子的溶液,如图所示加入氨水,开始没有沉淀,说明硝酸过量,消耗10mL氨水中和过量硝酸,继续加入氨水,开始生产氢氧化铝和氢氧化铜沉淀,当消耗氨水70mL时,沉淀完全,铝离子和铜离子全部转化为氢氧化铝和氢氧化铜沉淀,由于氢氧化铝不与氨水反应,氢氧化铜可溶于氨水,继续加入氨水,部分沉淀开始溶解,当消耗氨水100mL时,氢氧化铜完全溶解,剩余氢氧化铝沉淀,再继续加入氨水,沉淀量不变,据此分析计算解答。
(1)根据分析,图中滴加氨水10~100mL 的过程为铝离子和铜离子全部转化为氢氧化铝和氢氧化铜沉淀,氢氧化铜完全溶解的过程,其中铜元素参与反应的离子方程式为Cu2++2NH3·H2O=Cu(OH)2↓+2![]() ,Cu(OH)2+4
,Cu(OH)2+4![]() =
=![]() +2OH-+4H2O;
+2OH-+4H2O;
(2)根据反应:H++ NH3·H2O=![]() + H2O,过量的硝酸的物质的量=0.01L×3mol/L=0.03mol,完全根据3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,Cu2++2NH3·H2O=Cu(OH)2↓+2
+ H2O,过量的硝酸的物质的量=0.01L×3mol/L=0.03mol,完全根据3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,Cu2++2NH3·H2O=Cu(OH)2↓+2![]() ,8HNO3~3Cu2+~6NH3·H2O,根据Al+4HNO3=Al(NO3)3+NO↑+2H2O, Al3++3NH3·H2O=Al(OH)3↓+3
,8HNO3~3Cu2+~6NH3·H2O,根据Al+4HNO3=Al(NO3)3+NO↑+2H2O, Al3++3NH3·H2O=Al(OH)3↓+3![]() ,8HNO3~2Al3+~6NH3·H2O,则根据上述分析,消耗硝酸与完全沉淀消耗的氨水的物质的量的关系为4HNO3~3NH3·H2O,根据图像沉淀铝离子和铜离子消耗氨水的总物质的量=0.06L×3 mol/L=0.18mol,则反应中消耗的硝酸的物质的量为0.03mol+
,8HNO3~2Al3+~6NH3·H2O,则根据上述分析,消耗硝酸与完全沉淀消耗的氨水的物质的量的关系为4HNO3~3NH3·H2O,根据图像沉淀铝离子和铜离子消耗氨水的总物质的量=0.06L×3 mol/L=0.18mol,则反应中消耗的硝酸的物质的量为0.03mol+![]() ×0.18mol=0.27mol,则100mL该硝酸的浓度=
×0.18mol=0.27mol,则100mL该硝酸的浓度=![]() =2.7mol/L。
=2.7mol/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关描述及化学用语的表示方法正确的是( )
A.原子核内有8个中子的基态碳原子价电子排布图为:![]()
B.NH4F的电子式为:![]() ,三种元素中氟的第一电离能最大
,三种元素中氟的第一电离能最大
C.铜属于d区元素,溴属于p区元素,二者基态原子未成对电子数目相同
D.CO2分子的结构式为:O=C=O,碳的原子半径大于氧的原子半径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.0100 mol/L的NaOH溶液滴定10. 00 mL 0.0100 mol/L的二元酸H2A,滴定过程中加入NaOH溶液的体积(V)与溶液中的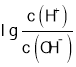 关系如图所示,下列说法正确的是( )
关系如图所示,下列说法正确的是( )

A.H2A的电离方程式为:H2A=A2-+2H+
B.B点显酸性的原因是HA的电离程度大于其水解程度
C.C点溶液显中性,所以 c(Na+)=c(A2-) +c(HA-)
D.常温下Kh(Na2 A)的数量级约为10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.按系统命名法,化合物![]() 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C.苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段 的高聚物,其单体是苯酚和甲醛
的高聚物,其单体是苯酚和甲醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为常见的短周期主族元素,常温下,其最高价氧化物对应的水化物溶液(浓度均为 0.01mol/L)的pH和原子半径的关系如下图所示。其中,Y为碳元素。下列有关说法正确的是

A. X是硫元素
B. Y的最高价氧化物的电子式为 ![]()
C. W的最高价氧化物对应的水化物中仅含离子键
D. Z的最高价氧化物对应水化物的化学式为HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.28g乙烯和环烷的混合气体中含有的碳原子数为2NA
B.2.0gD2O中含有的质子数、电子数均为NA
C.常温下,5.6gFe与含0.2molHNO3的溶液充分作用,最少失去的电子数为0.15NA
D.含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下用等浓度的NaOH溶液滴定25.00mL0.1000mol·L-1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系正确的是( )
已知:①Ka1(H2C2O4)=5.4×10-2 Ka2(H2C2O4)=5.4×10-5
②设H2C2O4溶液中c(总)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
A.滴入NaOH溶液体积为25.00mL时:c(Na+)>c(H2C2O4)>c(C2O42-)>c(H+)
B.pH=7的溶液:c(Na+)=c(C2O42-)+c(HC2O4-)
C.当c(Na+)=2c(总)时:c(OH-)=c(H+)+c((HC2O4-)+c(H2C2O4)
D.0.1000mol·L-1H2C2O4溶液:c(H+)=0.1000mol·L-1+c(C2O42-)+c(OH-)-c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积的数据:
温度 | 25 |
|
|
水的离子积 |
| a |
|
试回答以下问题
(1)若![]() ,则a______1×10-14填“<”“>”或“=”)。
,则a______1×10-14填“<”“>”或“=”)。
(2)250C时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中![]() :
:![]() ______。
______。
(3)在![]() 温度下测得某溶液
温度下测得某溶液![]() ,该溶液显______
,该溶液显______![]() 填“酸”、“碱”或“中”
填“酸”、“碱”或“中”![]() 性
性![]() 将此温度下
将此温度下![]() 的NaOH溶液aL与
的NaOH溶液aL与![]() 的
的![]() 溶液bL混合,若所得混合液
溶液bL混合,若所得混合液![]() ,则a:b______。
,则a:b______。
(4)某同学用0.1 mol·L-1的NaOH溶液分别滴定20.00 mL0.1 mol·L-1的HCl溶液和0.1 mol·L-1的CH3COOH溶液,得到如图所示的两条滴定曲线,请回答有关问题:
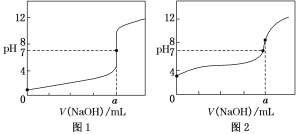
①0.1 mol·L-1的NaOH溶液滴定0.1 mol·L-1的CH3COOH溶液的曲线是______(填“图1”或“图2”)曲线。
②a=________。
(5)某同学用0.1 mol·L-1的NaOH溶液分别滴定20.00 mL未知浓度的HCl溶液选用_______作指示剂,若装标准液的滴定管未润洗则会导致测定结果________(填“偏高”或“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是
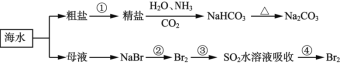
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.侯氏制碱应先通NH3再通CO2
C.在第②、③、④步骤中,溴元素均被氧化
D.③④的目的是进行溴的富集
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com