
【题目】下表是不同温度下水的离子积的数据:
温度 | 25 |
|
|
水的离子积 |
| a |
|
试回答以下问题
(1)若![]() ,则a______1×10-14填“<”“>”或“=”)。
,则a______1×10-14填“<”“>”或“=”)。
(2)250C时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中![]() :
:![]() ______。
______。
(3)在![]() 温度下测得某溶液
温度下测得某溶液![]() ,该溶液显______
,该溶液显______![]() 填“酸”、“碱”或“中”
填“酸”、“碱”或“中”![]() 性
性![]() 将此温度下
将此温度下![]() 的NaOH溶液aL与
的NaOH溶液aL与![]() 的
的![]() 溶液bL混合,若所得混合液
溶液bL混合,若所得混合液![]() ,则a:b______。
,则a:b______。
(4)某同学用0.1 mol·L-1的NaOH溶液分别滴定20.00 mL0.1 mol·L-1的HCl溶液和0.1 mol·L-1的CH3COOH溶液,得到如图所示的两条滴定曲线,请回答有关问题:
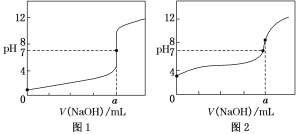
①0.1 mol·L-1的NaOH溶液滴定0.1 mol·L-1的CH3COOH溶液的曲线是______(填“图1”或“图2”)曲线。
②a=________。
(5)某同学用0.1 mol·L-1的NaOH溶液分别滴定20.00 mL未知浓度的HCl溶液选用_______作指示剂,若装标准液的滴定管未润洗则会导致测定结果________(填“偏高”或“偏低”或“无影响”)
【答案】![]() 1000:1 碱性 9:11 图2 20.00mL 酚酞或甲基橙 偏高
1000:1 碱性 9:11 图2 20.00mL 酚酞或甲基橙 偏高
【解析】
(1)由于水的电离电离过程为吸热反应,温度越高,水的电离程度越大,水的离子积越大;
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,则溶液中钠离子浓度是1×10-3mol/L,如果稀释10倍,则钠离子浓度是1×10-4mol/L,但硫酸钠溶液是显中性,溶液中c(OH-)是1×10-7mol/L;
(3)根据表中数据可知,在t2温度下,溶液pH=6时,溶液显中性,若pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合所得混合液pH=2,反应后溶液中氢离子的浓度是0.01mol/L;
(4)①滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1;
②当酸碱恰好反应时,盐酸和醋酸消耗NaOH溶液的体积相等,溶液pH=7;
(5)0.1 mol·L-1的NaOH溶液分别滴定20.00 mL未知浓度的HCl溶液选用酚酞或甲基橙对实验结果影响不大;若装标准液的滴定管未润洗,标准溶液浓度会减小,消耗标准溶液体积偏大。
(1)由于水的电离电离过程为吸热反应,温度越高,水的电离程度越大,水的离子积越大,所以若25℃<t1<t2,故答案为:>;
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,则溶液中钠离子浓度是1×10-3mol/L,如果稀释10倍,则钠离子浓度是1×10-4mol/L,硫酸钠溶液是显中性的,则c(Na+):c(OH-)=10-4:10-7=1000:1,故答案为:1000:1;
(3)根据表中数据可知,在t2温度下,溶液pH=6时,溶液显中性,在t2温度下测得某溶液pH=7,该溶液显碱性;若pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合所得混合液pH=2,反应后溶液中氢离子的浓度是0.01mol/L,则![]() =0.01,,解得a∶b=9∶11,故答案为:碱性;9:11;
=0.01,,解得a∶b=9∶11,故答案为:碱性;9:11;
(4)①滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图1,滴定醋酸的曲线是图2,故答案为:图2;
②当酸碱恰好反应时,盐酸和醋酸消耗NaOH溶液的体积相等,溶液pH=7,由图可知0.1 mol·L-1的NaOH溶液滴定20.00 mL0.1 mol·L-1的HCl溶液时,a点溶液pH=7,则氢氧化钠溶液的体积为20.00 mL,即a=20.00 mL,故答案为:20.00 mL;
(5)0.1 mol·L-1的NaOH溶液分别滴定20.00 mL未知浓度的HCl溶液选用酚酞或甲基橙对实验结果影响不大,选用酚酞或甲基橙都可以;若装标准液的滴定管未润洗,标准溶液浓度会减小,消耗标准溶液体积偏大,导致测定结果偏高,故答案为:酚酞或甲基橙;偏高。


科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一包铝粉和铜粉的混合物,用100mL 某浓度的稀硝酸溶解,生成的气体全部是NO, 待粉末完全溶解后,逐滴加入3molL-1 的氨水,产生沉淀的物质的量与加入氨水的体积关系如图。
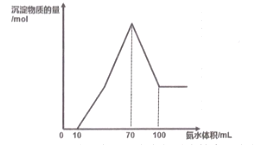
(1)写出图中滴加氨水10~100mL 的过程中铜元素参与反应的离子方程式_________。
(2)所用硝酸的物质的量浓度为______mol L-1;写出简要计算过程______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉在一定条件下发生下列转化关系:

已知:化合物H中含有一个甲基。请回答:
(1)写出B的电子式___;化合物D中的官能团名称___。
(2)E+H→G的化学方程式:___。
(3)下列说法不正确的是___。
A.化合物A和D能与银氨溶液反应生成光亮的银镜
B.用新制的氢氧化铜不能区分化合物C、D、E
C.相同质量的A、E和H充分燃烧时消耗等量的氧气
D.化合物F与G互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙醇合成部分有机物的路线如下:
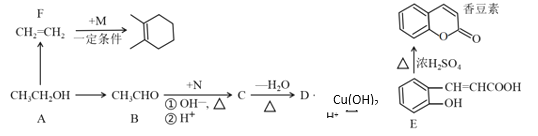
已知:CH3CHO+CH3CHO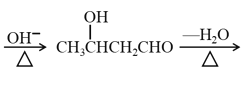 CH3CH=CHCHO
CH3CH=CHCHO
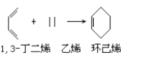
(1)香豆素所含官能团名称_____________。
(2)M的名称_________。
(3)N的结构简式____________。
(4)B与银氨溶液反应方程式___________________。
(5)香豆素在NaOH溶液中发生水解反应的化学方程式为_____________。
(6)由A到F反应的化学方程式___________。
(7)以乙醇为起始原料,无机试剂任选,合成CH3CH=CHCOOC2H5写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是一种相对分子质量为92的芳香烃,以X为原料制备部分有机物的路线如下:
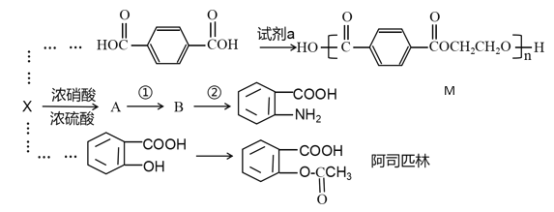
已知:![]()
(1)第①步和第②步顺序不能互换的原因_____。
(2)写出X到A的反应方程式__________________________。
(3)A到B所用试剂___________。
(4)由X制备A时,简述配制混酸的方法____________________。
(5)试剂a___________(结构简式)。
(6)M为涤纶,是一种高分子聚合物,有关M的说法正确的是___。
A.M其中一种单体对苯二甲酸和苯甲酸互为同系物
B.1mol 该物质与氢氧化钠溶液反应,理论上最多可以消耗2n mol NaOH
C.生成该聚合物的反应属于加聚反应
D.涤纶是对苯二甲酸和乙醇通过缩聚反应得到
(7)写出同时满足条件的阿司匹林的同分异构体结构简式________________。
①含有苯环且水解产物能与FeCl3溶液发生显色反应
②能发生银镜反应
③核磁共振氢谱为4组峰,且峰面积之比为1:2:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ是NO2(g)+CO(g)CO2(g)+NO(g)应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
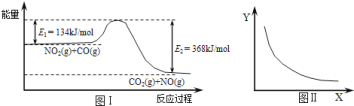
下列有关说法正确的是
A.一定条件下,向密闭容器中加入1 mol NO2(g)与1 mol CO(g)反应放出234kJ热量
B.若X表示温度,则Y表示的可能是CO2的物质的量浓度
C.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
D.若X表示反应时间,则Y表示的可能是混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
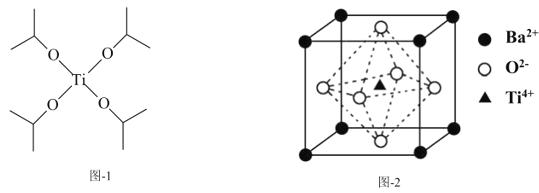
【题目】钛被誉为“现代金属”和“战略金属”。
(1)Ti基态核外电子排布式为___。
(2)TiO2与BaCO3一起熔融可制得偏钛酸钡,CO32-的空间构型为___;与CO32-互为等电子体的分子是___。
(3)四异丙醇钛(C12H28O4Ti)结构如图-1所示,1mol四异丙醇钛中含有σ键的数目为___mol。
(4)偏钛酸钡的晶体结构如图-2所示,则偏钛酸钡的化学式为___;与Ba2+最近且等距离的O2-为___个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com