
【题目】X是一种相对分子质量为92的芳香烃,以X为原料制备部分有机物的路线如下:
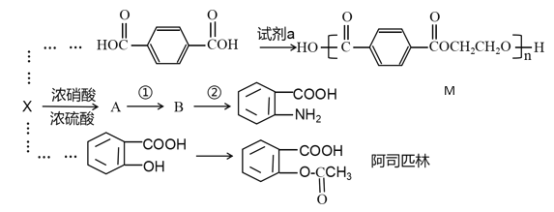
已知:![]()
(1)第①步和第②步顺序不能互换的原因_____。
(2)写出X到A的反应方程式__________________________。
(3)A到B所用试剂___________。
(4)由X制备A时,简述配制混酸的方法____________________。
(5)试剂a___________(结构简式)。
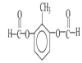
(6)M为涤纶,是一种高分子聚合物,有关M的说法正确的是___。
A.M其中一种单体对苯二甲酸和苯甲酸互为同系物
B.1mol 该物质与氢氧化钠溶液反应,理论上最多可以消耗2n mol NaOH
C.生成该聚合物的反应属于加聚反应
D.涤纶是对苯二甲酸和乙醇通过缩聚反应得到
(7)写出同时满足条件的阿司匹林的同分异构体结构简式________________。
①含有苯环且水解产物能与FeCl3溶液发生显色反应
②能发生银镜反应
③核磁共振氢谱为4组峰,且峰面积之比为1:2:2:3
【答案】如果互换,第二步甲基被氧化成羧基的同时氨基也会被氧化成硝基 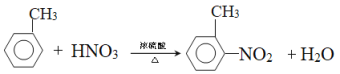 酸性高锰酸钾溶液 取一定量的浓硝酸于烧杯中,将浓硫酸沿器壁慢慢滴下,并不断用玻璃棒搅拌 HOCH2CH2OH B
酸性高锰酸钾溶液 取一定量的浓硝酸于烧杯中,将浓硫酸沿器壁慢慢滴下,并不断用玻璃棒搅拌 HOCH2CH2OH B 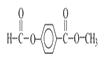
![]()
【解析】
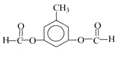
X是一种相对分子质量为92的芳香烃,则X的分子式为C7H8,则X为![]() ,由已知信息可推断B为
,由已知信息可推断B为![]() ,则A为
,则A为![]() ,由此分析。
,由此分析。
(1)酸性高猛酸钾溶液具有强氧化性,如果互换第二步甲基被氧化成羧基的同时氨基也会被氧化成硝基,故答案为:如果互换,甲基被氧化成羧基的同时氨基也会被氧化成硝基;
(2)X到A发生硝化反应,反应的反应方程式为 ;
;
(3)A到B需将苯环上甲基氧化成羧基,故用酸性高锰酸钾溶液,故答案为:酸性高锰酸钾溶液;
(4)配制浓硝酸与浓硫酸混酸的方法:取一定量的浓硝酸于烧杯中,将浓硫酸沿杯壁慢慢流下,并不断用玻璃棒搅拌,防止浓硫酸溶解时放出大量热导致液体飞溅,故答案为:取一定量的浓硝酸于烧杯中,将浓硫酸沿杯壁流下,并不断用玻璃棒搅拌;
(5)由图可知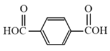 和试剂a发生缩聚反应生成M,则试剂a为HOCH2CH2OH,故答案为:HOCH2CH2OH;
和试剂a发生缩聚反应生成M,则试剂a为HOCH2CH2OH,故答案为:HOCH2CH2OH;
(6)A.M其中一种单体对苯二甲酸和苯甲酸官能团个数不同不是同系物,故A错误;
B.1mol 该物质含有2nmol酯键,理论上最多可以消耗2n mol NaOH,故B正确;
C.生成该聚合物的反应属于缩聚反应,故C错误;
D. 涤纶是对苯二甲酸和乙二醇通过缩聚反应得到,故D错误;
故答案选:B。
(7)①含有苯环且水解产物能与FeCl3溶液发生显色反应;②能发生银镜反应;③核磁共振氢谱为4组峰,且峰面积之比为1:2:2:3,则含有官能团酚羟基形成的酯基、醛基、酯基等,4种不同位置的氢且氢的个数比为1:2:2:3,符合上述条件的同分异构体有
![]()

 四种,故答案为:
四种,故答案为:
![]()

 。
。


科目:高中化学 来源: 题型:
【题目】常温下,用0.0100 mol/L的NaOH溶液滴定10. 00 mL 0.0100 mol/L的二元酸H2A,滴定过程中加入NaOH溶液的体积(V)与溶液中的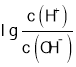 关系如图所示,下列说法正确的是( )
关系如图所示,下列说法正确的是( )

A.H2A的电离方程式为:H2A=A2-+2H+
B.B点显酸性的原因是HA的电离程度大于其水解程度
C.C点溶液显中性,所以 c(Na+)=c(A2-) +c(HA-)
D.常温下Kh(Na2 A)的数量级约为10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下用等浓度的NaOH溶液滴定25.00mL0.1000mol·L-1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系正确的是( )
已知:①Ka1(H2C2O4)=5.4×10-2 Ka2(H2C2O4)=5.4×10-5
②设H2C2O4溶液中c(总)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
A.滴入NaOH溶液体积为25.00mL时:c(Na+)>c(H2C2O4)>c(C2O42-)>c(H+)
B.pH=7的溶液:c(Na+)=c(C2O42-)+c(HC2O4-)
C.当c(Na+)=2c(总)时:c(OH-)=c(H+)+c((HC2O4-)+c(H2C2O4)
D.0.1000mol·L-1H2C2O4溶液:c(H+)=0.1000mol·L-1+c(C2O42-)+c(OH-)-c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积的数据:
温度 | 25 |
|
|
水的离子积 |
| a |
|
试回答以下问题
(1)若![]() ,则a______1×10-14填“<”“>”或“=”)。
,则a______1×10-14填“<”“>”或“=”)。
(2)250C时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中![]() :
:![]() ______。
______。
(3)在![]() 温度下测得某溶液
温度下测得某溶液![]() ,该溶液显______
,该溶液显______![]() 填“酸”、“碱”或“中”
填“酸”、“碱”或“中”![]() 性
性![]() 将此温度下
将此温度下![]() 的NaOH溶液aL与
的NaOH溶液aL与![]() 的
的![]() 溶液bL混合,若所得混合液
溶液bL混合,若所得混合液![]() ,则a:b______。
,则a:b______。
(4)某同学用0.1 mol·L-1的NaOH溶液分别滴定20.00 mL0.1 mol·L-1的HCl溶液和0.1 mol·L-1的CH3COOH溶液,得到如图所示的两条滴定曲线,请回答有关问题:
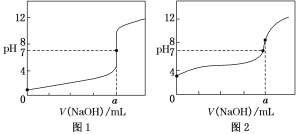
①0.1 mol·L-1的NaOH溶液滴定0.1 mol·L-1的CH3COOH溶液的曲线是______(填“图1”或“图2”)曲线。
②a=________。
(5)某同学用0.1 mol·L-1的NaOH溶液分别滴定20.00 mL未知浓度的HCl溶液选用_______作指示剂,若装标准液的滴定管未润洗则会导致测定结果________(填“偏高”或“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
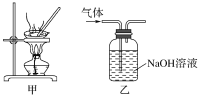
A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
B.将4.0 g NaOH固体置于100 mL容量瓶中,加水至刻度,配制1.000 molL-1 NaOH溶液
C.用装置甲蒸干AlCl3溶液制无水AlCl3固体
D.用装置乙除去实验室所制乙烯中的少量SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸是唯一具有脂溶性的果酸,在医药工业可用于头孢羟唑、血管扩张药环扁桃酸酯、滴眼药羟苄唑、匹莫林等的中间体,也可作防腐剂。实验室用如下原理制备:

合成扁桃酸的实验步骤、装置示意图及相关数据如下:
物质 | 状态 | 熔点/℃ | 沸点/℃ | 溶解性 |
扁桃酸 | 无色透明晶体 | 119 | 300 | 易溶于热水、乙醚和异丙醇 |
乙醚 | 无色透明液体 | -116.3 | 34.6 | 溶于低碳醇、苯、氯仿,微溶于水 |
苯甲醛 | 无色液体 | -26 | 179 | 微溶于水,能与乙醇、乙醚、苯、氯仿等混溶 |
氯仿 | 无色液体 | -63.5 | 61.3 | 易溶于醇、醚、苯、不溶于水 |
实验步骤:

步骤一:向如图所示的实验装置中加入0.1mol(约l0.1mL)苯甲醛、0.2mol(约16mL)氯仿,慢慢滴入含19g氢氧化钠的溶液,维持温度在55~60℃,搅拌并继续反应1h,当反应液的pH接近中性时可停止反应。
步骤二:将反应液用200mL水稀释,每次用20mL乙醚萃取两次,合并醚层,待回收。
步骤三:水相用50%的硫酸酸化至pH为2~3后,再每次用40mL乙醚分两次萃取,合并萃取液并加入适量无水硫酸钠,蒸出乙醚,得粗产品约11.5g。请回答下列问题:
(1)图中仪器C的名称是_________________,装置B的作用是_____________
(2)步骤一中合适的加热方式是_____________________。
(3)步骤二中用乙醚的目的是_____________________。
(4)步骤三中加入适量无水硫酸钠的目的是_____________________。
(5)该实验的产率为____________(保留三位有效数字)。
(6)扁桃酸在高端化学中也有很重要的作用,如以扁桃酸与正丁醇为原料,在催化剂的催化下可合成手性拆分剂扁桃酸正丁酯,试写出该反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发)。下列叙述不正确的是
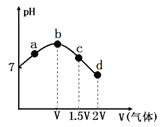
A.由a点到b点的过程中,溶液中 增大
增大
B.由图可知(NH4)2CO3溶液显碱性、NH4Cl溶液显酸性
C.c点所示溶液中,c(NH4+)>c(CO32-)>c(OH-)>c(H+)
D.d点所示溶液中,c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是
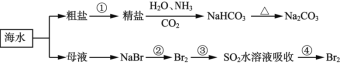
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.侯氏制碱应先通NH3再通CO2
C.在第②、③、④步骤中,溴元素均被氧化
D.③④的目的是进行溴的富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯仿![]() 常因保存不慎而被氧化,产生剧毒物光气
常因保存不慎而被氧化,产生剧毒物光气![]() :
:![]() ,下列说法不正确的有
,下列说法不正确的有![]()
![]()

A. ![]() 分子为含极性键的非极性分子
分子为含极性键的非极性分子
B. ![]() 分子中含有3个
分子中含有3个![]() 键、一个
键、一个![]() 键,中心C原子采用
键,中心C原子采用![]() 杂化
杂化
C. ![]() 分子中所有原子的最外层电子都满足8电子稳定结构
分子中所有原子的最外层电子都满足8电子稳定结构
D. 使用前可用硝酸银稀溶液检验氯仿是否变质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com