
【题目】常温下,用0.0100 mol/L的NaOH溶液滴定10. 00 mL 0.0100 mol/L的二元酸H2A,滴定过程中加入NaOH溶液的体积(V)与溶液中的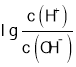 关系如图所示,下列说法正确的是( )
关系如图所示,下列说法正确的是( )

A.H2A的电离方程式为:H2A=A2-+2H+
B.B点显酸性的原因是HA的电离程度大于其水解程度
C.C点溶液显中性,所以 c(Na+)=c(A2-) +c(HA-)
D.常温下Kh(Na2 A)的数量级约为10-4
【答案】D
【解析】
A. A点,0.01mol/L的H2A,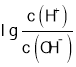 =10,则
=10,则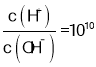 ,c(H+)=
,c(H+)=![]() mol/L,则H2A不完全电离,电离方程式为:H2A
mol/L,则H2A不完全电离,电离方程式为:H2A![]() HA-+H+,HA-
HA-+H+,HA-![]() A2-+H+,故A错误;
A2-+H+,故A错误;
B. B点时,溶质为NaHA,溶液显酸性的原因是HA-的电离程度大于其水解程度,故B错误;
C. C点溶液显中性,则c(H+)=c(OH-),根据电荷守恒知:c(Na+)+ c(H+)=2c(A2-)+c(HA-)+c(OH-),所以 c(Na+)=2c(A2-)+c(HA-),故C错误;
D. D点时,溶质Na2 A,此时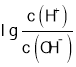 =-8,则
=-8,则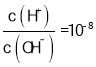 ,根据水的离子积计算得c(OH-)=10-3mol/L,根据A2-+H2O -
,根据水的离子积计算得c(OH-)=10-3mol/L,根据A2-+H2O -![]() HA-+OH-得,常温下Kh (Na2A)=
HA-+OH-得,常温下Kh (Na2A)=![]() ,故D正确;
,故D正确;
故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:
【题目】在恒容绝热密闭容器中发生CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g),下列情况都能说明该反应已达到平衡状态的是
2N2(g)+CO2(g)+2H2O(g),下列情况都能说明该反应已达到平衡状态的是
①容器内混合气体的平均相对分子质量不再变化;
②容器内气体分子个数不再发生变化;
③容器内气体的压强不再发生变化;
④v正(NO):v逆(N2):V逆(CO2)=4:2:1
A.①②③B.③④C.①②③④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HCHO与O2在羟基磷灰石(HAP)表面反应通过两步反应生成CO2、H2O的机理如图所示(图中只给出了HAP的部分结构)。下列说法错误的是( )
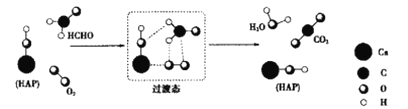
A.HCHO在反应过程中,所有C-H键都发生断裂
B.反应第一步是吸热过程
C.产物H2O中的O全部来自于O2
D.HAP是该反应的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 25℃下时,NH3·H2O kb=1.77×10-5;H2CO3 ka1=4.30×10-7、ka2=5.61×10-11。 25℃时有关NH4HCO3溶液的说法中正确的是
A. 呈弱酸性
B. c(OH-)+c(NH3·H2O)=c(H+)+c(H2CO3)
C. 滴入NaOH 溶液发生反应:NH4++OH-=NH3·H2O和HCO3-+OH-=H2O+CO32-
D. 滴入NaOH溶液,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期包含18种元素,其中多种元素具有重要的用途,在现代工业中备受青睐。
(l)铁位于元素周期表____区,Fe3+的价电子排布式为 ____。
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,可用en代表,其能够与Cu2+形成稳定环状配离子,可表示为[Cu(en)2]2+,其中Cu2+的配位数为____。1 mol[Cu(en)2]C12中含有σ键的数目为____。
(3)气态SeO3为单分子,该分子中Se原子的杂化轨道类型为 ___。用物质结构理论解释H2SeO4比H2SeO3酸性强的原因:______________。
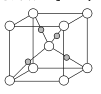
(4)如图为Cu2O的晶胞结构,其中黑球表示____原子(填元素符号);Cu2O的密度为pg·cm-3则晶胞的边长为 ___cm。(用NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G 为短周期主族元素,其原子半径与最外层电子数的关系如图,下列说法正确的是
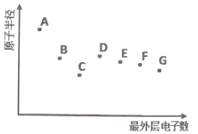
A.根据元素B 在元素周期表中的位置推测,其最高价氧化物对应的水化物可能具有两性
B.元素D在自然界中主要以游离态存在,其单质可用作半导体材料
C.元素A的离子半径大于元素G的离子半径
D.元素F 的气态氢化物比元素G的气态氢化物更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一包铝粉和铜粉的混合物,用100mL 某浓度的稀硝酸溶解,生成的气体全部是NO, 待粉末完全溶解后,逐滴加入3molL-1 的氨水,产生沉淀的物质的量与加入氨水的体积关系如图。
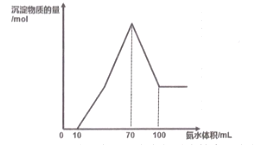
(1)写出图中滴加氨水10~100mL 的过程中铜元素参与反应的离子方程式_________。
(2)所用硝酸的物质的量浓度为______mol L-1;写出简要计算过程______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是一种相对分子质量为92的芳香烃,以X为原料制备部分有机物的路线如下:
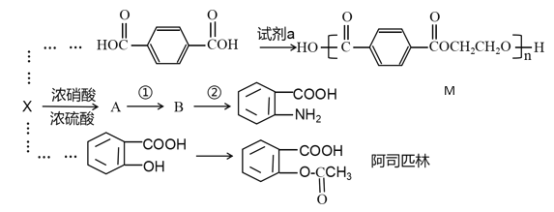
已知:![]()
(1)第①步和第②步顺序不能互换的原因_____。
(2)写出X到A的反应方程式__________________________。
(3)A到B所用试剂___________。
(4)由X制备A时,简述配制混酸的方法____________________。
(5)试剂a___________(结构简式)。
(6)M为涤纶,是一种高分子聚合物,有关M的说法正确的是___。
A.M其中一种单体对苯二甲酸和苯甲酸互为同系物
B.1mol 该物质与氢氧化钠溶液反应,理论上最多可以消耗2n mol NaOH
C.生成该聚合物的反应属于加聚反应
D.涤纶是对苯二甲酸和乙醇通过缩聚反应得到
(7)写出同时满足条件的阿司匹林的同分异构体结构简式________________。
①含有苯环且水解产物能与FeCl3溶液发生显色反应
②能发生银镜反应
③核磁共振氢谱为4组峰,且峰面积之比为1:2:2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com