
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.28g乙烯和环烷的混合气体中含有的碳原子数为2NA
B.2.0gD2O中含有的质子数、电子数均为NA
C.常温下,5.6gFe与含0.2molHNO3的溶液充分作用,最少失去的电子数为0.15NA
D.含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA
【答案】C
【解析】
C.Fe和HNO3反应有四种情况,①和稀硝酸反应,Fe过量,氧化产物是Fe(NO3)2且HNO3反应完全,此时![]() 计算;②和稀硝酸反应,HNO3过量,Fe完全反应,氧化产物是Fe(NO3)3,此时用
计算;②和稀硝酸反应,HNO3过量,Fe完全反应,氧化产物是Fe(NO3)3,此时用![]() ;③和浓硝酸反应,Fe过量,HNO3反应完,氧化产物是Fe(NO3)2,还原产物是NO2,此时用
;③和浓硝酸反应,Fe过量,HNO3反应完,氧化产物是Fe(NO3)2,还原产物是NO2,此时用![]() 计算;④和浓硝酸反应, HNO3过量,Fe反应完,氧化产物是Fe(NO3)3,还原产物是NO2,此时用
计算;④和浓硝酸反应, HNO3过量,Fe反应完,氧化产物是Fe(NO3)3,还原产物是NO2,此时用![]() 计算。本题中n(Fe):n(HNO3)=0.1:0.2=1:2﹥3:8﹥1:4﹥1:6,也就是说,Fe一定过量,那么就只需要考虑Fe过量、硝酸反应完的两种情况了。
计算。本题中n(Fe):n(HNO3)=0.1:0.2=1:2﹥3:8﹥1:4﹥1:6,也就是说,Fe一定过量,那么就只需要考虑Fe过量、硝酸反应完的两种情况了。
A.乙烯(C2H4)和环烷(CnH2n)最简式都为CH2,可看成混合物由一定物质的量的CH2组成,CH2的物质的量n=![]() =2mol,n(C)=2mol
=2mol,n(C)=2mol![]() 1=2mol,所以碳原子数为2NA,A正确;
1=2mol,所以碳原子数为2NA,A正确;
B.D2O即![]() ,所以n(D2O)=
,所以n(D2O)=![]() =0.1mol,n(质子)=0.1mol×10=1mol,n(电子)=0.1mol×10=1mol,质子数、电子数均为NA,B正确;
=0.1mol,n(质子)=0.1mol×10=1mol,n(电子)=0.1mol×10=1mol,质子数、电子数均为NA,B正确;
C.假设硝酸是稀硝酸,n(Fe):n(HNO3)=0.1:0.2=1:2﹥3:8,铁过量,HNO3反应完全且氧化产物是Fe(NO3)2,以HNO3的量计算, ,解得n1=0.15mol,假设硝酸是浓硝酸,n(Fe):n(HNO3)=0.1:0.2=1:2﹥1:4,Fe过量,HNO3反应完全且氧化产物是Fe(NO3)2,以HNO3的量计算
,解得n1=0.15mol,假设硝酸是浓硝酸,n(Fe):n(HNO3)=0.1:0.2=1:2﹥1:4,Fe过量,HNO3反应完全且氧化产物是Fe(NO3)2,以HNO3的量计算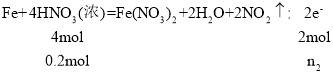 ,解得n2=0.1mol,C错误;
,解得n2=0.1mol,C错误;
D.电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-),中性时:c(H+)=c(OH-),所以c(NH4+)= (Cl-),D正确。
答案选C。


科目:高中化学 来源: 题型:
【题目】如图为Lil晶体锂电池的工作示意图,该电池具有使用寿命长、电压稳定等优点,常用于心脏起搏器的电源。下列说法错误的是( )
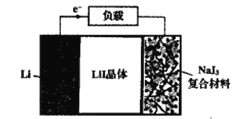
A.NaI3为电池的正极材料
B.电池工作时,Li+由NaI3移动到Li电极
C.正极电极反应为:2Li++NaI3+2e-=2LiI+NaI
D.该电池的总反应为:2Li+NaI3=2LiI+NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期包含18种元素,其中多种元素具有重要的用途,在现代工业中备受青睐。
(l)铁位于元素周期表____区,Fe3+的价电子排布式为 ____。
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,可用en代表,其能够与Cu2+形成稳定环状配离子,可表示为[Cu(en)2]2+,其中Cu2+的配位数为____。1 mol[Cu(en)2]C12中含有σ键的数目为____。
(3)气态SeO3为单分子,该分子中Se原子的杂化轨道类型为 ___。用物质结构理论解释H2SeO4比H2SeO3酸性强的原因:______________。
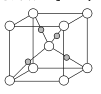
(4)如图为Cu2O的晶胞结构,其中黑球表示____原子(填元素符号);Cu2O的密度为pg·cm-3则晶胞的边长为 ___cm。(用NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X 中含有下表中离子若干种,且离子浓度均为相等(不考虑水的电离与离子水解)。向X 中加入足量稀盐酸,有无色气体生成, 经分析反应前后阴离子种类没有变化,下列说法正确的是
阳离子 | Na+、Ca2+ 、Fe3+、Fe2+、Al3+、Mg2+ |
阴离子 | OH-、 |
A.溶液X 中可能有![]() 或
或![]() 中的一种或两种都有
中的一种或两种都有
B.溶液X 中是否有Na+不能确定,需通过焰色反应来确定
C.溶液X 中可能有2 种阳离子,3 种阴离子
D.原溶液一定没有Al3+、Fe 3+,但Na+,、![]() 不确定
不确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一包铝粉和铜粉的混合物,用100mL 某浓度的稀硝酸溶解,生成的气体全部是NO, 待粉末完全溶解后,逐滴加入3molL-1 的氨水,产生沉淀的物质的量与加入氨水的体积关系如图。
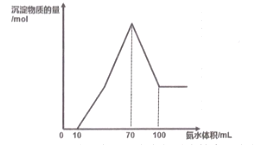
(1)写出图中滴加氨水10~100mL 的过程中铜元素参与反应的离子方程式_________。
(2)所用硝酸的物质的量浓度为______mol L-1;写出简要计算过程______。
查看答案和解析>>
科目:高中化学 来源: 题型:
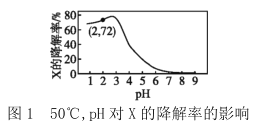
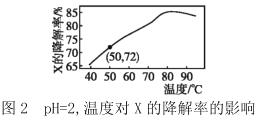
【题目】在10min内,相同浓度的有机污染物X的降解率随pH和温度的关系如图1和图2所示。
下列说法不正确的是( )
A.50℃,pH=4时X降解速率大于pH=5时的降解速率
B.由图1和图2可知,随温度的升高和pH的增大X的降解率不一定增大
C.由图1和图2可判断反应最佳条件:pH=3,温度为80℃
D.若50℃,pH=2时降解速率v(X)=1.44×10-4mol·L-1·min-1,则初始c(X)=2.0×10-3mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉在一定条件下发生下列转化关系:

已知:化合物H中含有一个甲基。请回答:
(1)写出B的电子式___;化合物D中的官能团名称___。
(2)E+H→G的化学方程式:___。
(3)下列说法不正确的是___。
A.化合物A和D能与银氨溶液反应生成光亮的银镜
B.用新制的氢氧化铜不能区分化合物C、D、E
C.相同质量的A、E和H充分燃烧时消耗等量的氧气
D.化合物F与G互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙醇合成部分有机物的路线如下:
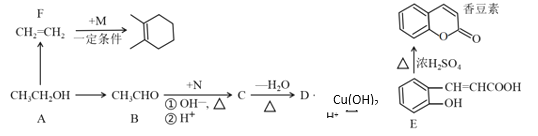
已知:CH3CHO+CH3CHO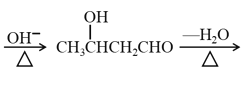 CH3CH=CHCHO
CH3CH=CHCHO
(1)香豆素所含官能团名称_____________。
(2)M的名称_________。
(3)N的结构简式____________。
(4)B与银氨溶液反应方程式___________________。
(5)香豆素在NaOH溶液中发生水解反应的化学方程式为_____________。
(6)由A到F反应的化学方程式___________。
(7)以乙醇为起始原料,无机试剂任选,合成CH3CH=CHCOOC2H5写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年3月,我国科学家研发出一种新型的锌碘单液流电池,其原理如图所示。下列说法不正确的是

A. 放电时B电极反应式为:I2+2e-=2I-
B. 放电时电解质储罐中离子总浓度增大
C. M为阳离子交换膜,N为阴离子交换膜
D. 充电时,A极增重65g时,C区增加离子数为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com