
【题目】环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以作内燃机的抗冻剂,J分子中无饱和碳原子。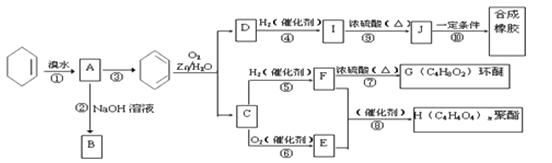
(1) C中含有的官能团的名称是________,E中含有的官能团的名称是_______
(2)写出下列反应类型: ⑥__________, ⑨_________。
(3)写出反应⑩的化学方程式:________________________________________________。
(4)有机物![]() 是一种广泛应用的高分子材料,请用环己烯和乙烯合成该有机物,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_____
是一种广泛应用的高分子材料,请用环己烯和乙烯合成该有机物,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_____
【答案】醛基羧基氧化反应消去反应![]()
【解析】
环己烯![]() 与溴发生加成反应生成A
与溴发生加成反应生成A![]() ,A在氢氧化钠水溶液,加热条件下发生水解反应生成B为
,A在氢氧化钠水溶液,加热条件下发生水解反应生成B为![]() ,A发生消去反应生成
,A发生消去反应生成![]() ,
,![]() 发生信息中反应生成OHCH2CH2CHO、OHCCHO,C与氢气发生加成反应生成F为醇,C发生氧化反应生成E为羧酸,故F、E含有一相同的碳原子数目,由F发生取代反应生成环醚G的分子式可知,C中含有2个碳原子,则D为OHCH2CH2CHO,C为OHCCHO,则F为HOCH2CH2OH,E为HOOCCOOH,2分子HOCH2CH2OH发生脱水反应生成环醚G为
发生信息中反应生成OHCH2CH2CHO、OHCCHO,C与氢气发生加成反应生成F为醇,C发生氧化反应生成E为羧酸,故F、E含有一相同的碳原子数目,由F发生取代反应生成环醚G的分子式可知,C中含有2个碳原子,则D为OHCH2CH2CHO,C为OHCCHO,则F为HOCH2CH2OH,E为HOOCCOOH,2分子HOCH2CH2OH发生脱水反应生成环醚G为![]() ,F、E通过酯化反应进行的缩聚反应生成聚酯H为
,F、E通过酯化反应进行的缩聚反应生成聚酯H为![]() ,D与氢气发生加成反应生成I为HOCH2CH2CH2OH,I在浓硫酸、加热条件下生成J,J分子中无饱和碳原子,应发生消去反应,可推知J 为CH2=CHCH=CH2,J发生加聚反应得到合成橡胶
,D与氢气发生加成反应生成I为HOCH2CH2CH2OH,I在浓硫酸、加热条件下生成J,J分子中无饱和碳原子,应发生消去反应,可推知J 为CH2=CHCH=CH2,J发生加聚反应得到合成橡胶![]() ,据此解答:(1)根据以上分析可知C的官能团为醛基,E的官能团为羧基;(2)C到E为醛到酸的氧化反应,I到J为醇的消去反应; (3) 反应⑩的化学方程式为
,据此解答:(1)根据以上分析可知C的官能团为醛基,E的官能团为羧基;(2)C到E为醛到酸的氧化反应,I到J为醇的消去反应; (3) 反应⑩的化学方程式为![]() ; (4)根据信息分析,环己烯在信息中的条件下反应生成己二醛,己二醛再 氧化生成己二酸,然后与乙二醇发生缩聚反应即可得到该物质,合成路线为
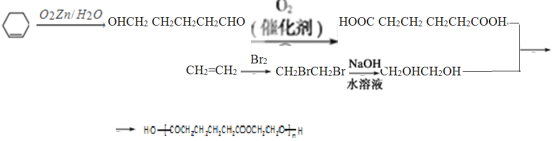
; (4)根据信息分析,环己烯在信息中的条件下反应生成己二醛,己二醛再 氧化生成己二酸,然后与乙二醇发生缩聚反应即可得到该物质,合成路线为


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1 L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是( )
A. T1时0~10 min NO2的平均反应速率为0.15 mol·L-1·min -1
B. T2时CH4的平衡转化率为70.0%
C. 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷与甲醇(CH3OH,液态)都属于清洁能源,已知每摩尔甲烷完全燃烧生成液态水和 CO2时放出的热量约为 890.3kJ,每摩尔甲醇完全燃烧生成液态水和 CO2 时放出的热量约为 726.0kJ。
(1)相同质量的甲烷与甲醇完全燃烧,生成液态水和 CO2 时放出热量较多的是_____。从共用电子对的偏离情况来看,甲烷分子中的共价键属于_____,甲醇分子的结构可以看成是甲烷分子中的一个H 原子被原子团(—OH)取代而得到,请根据甲烷的电子式写出甲醇分子的电子式_____。
(2)甲醇燃烧的热化学方程式为_____,1mol 甲醇完全燃烧,若生成水蒸气和 CO2 则放出的热量_____726.0kJ(填>、<或=)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,又是合成氨工业的重要原料.
(1)已知:![]()
![]()
甲烷和![]() 反应生成
反应生成![]() 和
和![]() 的热化学方程式为 ______ .
的热化学方程式为 ______ .
(2)工业合成氨的反应原理为![]() 某温度下,把10mol
某温度下,把10mol![]() 与28mol
与28mol![]() 置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为
置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为![]() ,则10min内该反应的平均速率
,则10min内该反应的平均速率![]() ______
______ ![]() ,则该温度下该反应的平衡常数
,则该温度下该反应的平衡常数![]() ______
______ ![]() 欲增大氮气的平衡转化率,可采取的措施有 ______
欲增大氮气的平衡转化率,可采取的措施有 ______ ![]() 写一种措施即可
写一种措施即可![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)⑧的元素符号是________(填写元素符号)。
(2)表中金属性最强的元素是____(填元素符号),该元素在周期表中的位置是_______。
(3)写出①、③、④最高价氧化物对应的水化物两两反应的化学方程式
_________________________________
_________________________________
_________________________________
(4)请设计一个实验方案,比较⑦、⑧非金属性的强弱(用化学方程式表示):_______。
(5)③、⑦两种元素形成的化合物的电子式为_____,⑦的气态氢化物的电子式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用Ba(OH)2溶液吸收氯气:2OH-+ 2Cl2 =2Cl-+ClO-+H2O
B. Cu 溶于稀HNO3: Cu + 2H++ NO3- = Cu2+ + NO2↑+ H2O
C. NO2溶于水:3NO2+H2O =2H++2NO3- +NO
D. 氯化镁溶液与氨水反应:Mg2+ + 2OH-= Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和实验现象所得到的实验结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向氯仿样品中加入硝酸银溶液 | 有白色沉淀产生 | 样品已变质 |
C | 向待测液中依次滴入氯水和KSCN溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com