
【题目】甲烷与甲醇(CH3OH,液态)都属于清洁能源,已知每摩尔甲烷完全燃烧生成液态水和 CO2时放出的热量约为 890.3kJ,每摩尔甲醇完全燃烧生成液态水和 CO2 时放出的热量约为 726.0kJ。
(1)相同质量的甲烷与甲醇完全燃烧,生成液态水和 CO2 时放出热量较多的是_____。从共用电子对的偏离情况来看,甲烷分子中的共价键属于_____,甲醇分子的结构可以看成是甲烷分子中的一个H 原子被原子团(—OH)取代而得到,请根据甲烷的电子式写出甲醇分子的电子式_____。
(2)甲醇燃烧的热化学方程式为_____,1mol 甲醇完全燃烧,若生成水蒸气和 CO2 则放出的热量_____726.0kJ(填>、<或=)。
【答案】甲烷 极性键 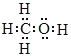 CH3OH(l)+
CH3OH(l)+ ![]() O2(g) = CO2(g)+2H2O(l) ΔH = –726kJ·mol-1 <
O2(g) = CO2(g)+2H2O(l) ΔH = –726kJ·mol-1 <
【解析】
据燃烧时的热量计算等质量甲烷、甲醇燃烧放出的热量;由共用电子对是否偏移判断共价键的类型;据热化学方程式的含义书写热化学方程式,并判断物质状态对反应热的影响。
(1)甲烷与甲醇的相对分子质量分别是16、32,32g甲烷、甲醇完全燃烧放出的热量分别是1780.6kJ、726.0kJ。故相同质量的甲烷与甲醇完全燃烧,甲烷放出热量较多。碳元素非金属性大于氢,碳氢间的共用电子对偏向于碳,故甲烷分子中的共价键属于极性键。甲醇是甲基和羟基组成,甲醇分子的电子式为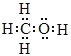 。
。
(2)据题意,甲醇燃烧的热化学方程式为CH3OH(l)+![]() O2(g) = CO2(g)+2H2O(l) ΔH = –726kJ·mol-1;
O2(g) = CO2(g)+2H2O(l) ΔH = –726kJ·mol-1;
因水蒸汽液化放热,1mol 甲醇完全燃烧生成水蒸气时放出的热量小于726.0kJ。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)元素⑩名称为____在周期表中的位置_____。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是____,碱性最强的化合物的电子式是:_____。
(3)用电子式表示素④与⑥的化合物的形成过程:_____,该化合物属于____(填“共价”或“离子”)化合物。
(4)写出一种由上述元素组成的既有离子键又有非极性共价键的物质的化学式_____。
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是_______(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些有机物质的分子式采取适当变形会简化计算.下列计算中错误的是( )
A. 等质量的甲烷、乙烯、乙炔充分燃烧,消耗的氧气的物质的量依次增多
B. Wg葡萄糖充分燃烧后,燃烧产物经过足量的Na2O2充分反应,固体质量增加Wg
C. 乙酸和两种链状单烯烃混合物中氧的质量分数为a,则碳的质量分数是![]()
D. 等物质的量的乙醇与丙烯酸![]() 充分燃烧,消耗的氧气的物质的量相同
充分燃烧,消耗的氧气的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用正确的是
A.手持试管给试管内的物质加热
B.用滴管滴加液体时滴管应垂直悬垂在容器上方且不能触及容器内壁
C.用天平称量药品时用手直接拿砝码
D.用燃着的酒精灯去点燃另一盏酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
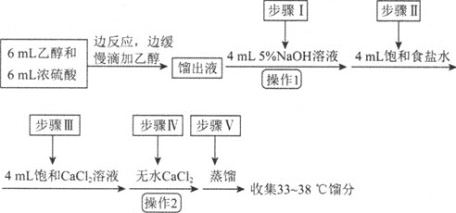
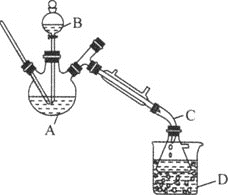
【题目】乙醚是有机合成中常用的溶剂。某实验小组在实验室利用乙醇脱水制备乙醚,装置示意图![]() 夹持和加热装置已略去
夹持和加热装置已略去![]() 、有关数据和实验步骤如下:
、有关数据和实验步骤如下:
物质 | 相对分子质量 | 密度 | 沸点 | 在水中的溶解性 |
乙醇 | 46 |
| 78 | 互溶 |
乙醚 | 74 |
|
| 不溶 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物![]() 。
。
请回答下列问题:
(1)仪器C的名称为_____。
(2)由乙醇制备乙醚的总反应为![]() ,此反应分两步进行,第一步反应的化学方程式为
,此反应分两步进行,第一步反应的化学方程式为![]() ,则第二步反应的化学方程式为_______。
,则第二步反应的化学方程式为_______。
(3)反应过程中,仪器B的末端应浸入反应液中,原因是___。
(4)仪器D中盛有冰水混合物,其作用为___。
(5)操作1的名称为____,操作2的名称为___。
(6)若省略步骤Ⅱ会导致的后果是_______。
(7)若实验过程中共加入18mL乙醇,最终得到8.7g乙醚,则乙醚的产率为______![]() 计算结果精确到
计算结果精确到![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为______。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为_______。
(3)与CN-互为等电子体的一种分子为______(填化学式);1mol Fe(CN)63-中含有σ键的数目为______。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于_______(填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为_______。
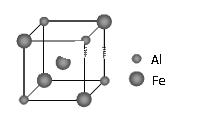
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以作内燃机的抗冻剂,J分子中无饱和碳原子。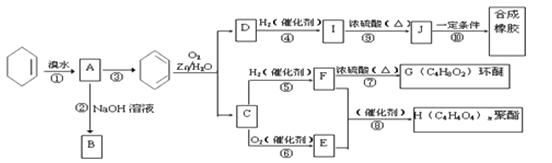
(1) C中含有的官能团的名称是________,E中含有的官能团的名称是_______
(2)写出下列反应类型: ⑥__________, ⑨_________。
(3)写出反应⑩的化学方程式:________________________________________________。
(4)有机物![]() 是一种广泛应用的高分子材料,请用环己烯和乙烯合成该有机物,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_____
是一种广泛应用的高分子材料,请用环己烯和乙烯合成该有机物,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为食品中常见的有机化合物,F是生活中常见的气体燃料,也是含氢百分含量最高的有机物,D和E有相同的元素组成。它们之间的转化关系如图:

请回答:
(1)有机物A中官能团的名称是________
(2)反应①的化学方程式___________
(3)F与氯气反应生成亿元取代物待测化学方程式___________
(4)下列说法正确的是____________
A.3个反应中的NaOH都起催化作用
B.反应⑤属于加成反应
C.A的同分异构体不能与金属钠反应生成氢气
D.1molB、1molC完全反应消耗NaOH的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 有能量变化的过程均为化学变化
B. 原电池是将电能转变为化学能的装置
C. 反应物的总能量高于生成物的总能量时发生放热反应
D. 旧化学键断裂所放出的能量低于新化学键形成所吸收的能量时发生吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com