
【题目】下列说法正确的是( )
A. 有能量变化的过程均为化学变化
B. 原电池是将电能转变为化学能的装置
C. 反应物的总能量高于生成物的总能量时发生放热反应
D. 旧化学键断裂所放出的能量低于新化学键形成所吸收的能量时发生吸热反应
科目:高中化学 来源: 题型:
【题目】甲烷与甲醇(CH3OH,液态)都属于清洁能源,已知每摩尔甲烷完全燃烧生成液态水和 CO2时放出的热量约为 890.3kJ,每摩尔甲醇完全燃烧生成液态水和 CO2 时放出的热量约为 726.0kJ。
(1)相同质量的甲烷与甲醇完全燃烧,生成液态水和 CO2 时放出热量较多的是_____。从共用电子对的偏离情况来看,甲烷分子中的共价键属于_____,甲醇分子的结构可以看成是甲烷分子中的一个H 原子被原子团(—OH)取代而得到,请根据甲烷的电子式写出甲醇分子的电子式_____。
(2)甲醇燃烧的热化学方程式为_____,1mol 甲醇完全燃烧,若生成水蒸气和 CO2 则放出的热量_____726.0kJ(填>、<或=)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用Ba(OH)2溶液吸收氯气:2OH-+ 2Cl2 =2Cl-+ClO-+H2O
B. Cu 溶于稀HNO3: Cu + 2H++ NO3- = Cu2+ + NO2↑+ H2O
C. NO2溶于水:3NO2+H2O =2H++2NO3- +NO
D. 氯化镁溶液与氨水反应:Mg2+ + 2OH-= Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列指定溶液中微粒的浓度关系正确的是
A. 0.1mol ·L-1Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+ c(H2CO3)
B. 0.1mol ·L-1NH4Cl溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. 0.2mol ·L-1H2C2O4(弱酸)与0.1mol ·L-1 NaOH溶液等体积混合的溶液中:2[c(H+)-c(OH-)]=3c(C2O42-)-c(H2C2O4)+ c(HC2O4-)
D. 0.1mol ·L-1Na2CO3溶液与同浓度等体积盐酸混合的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界水体中的碳元素主要以碳酸盐、碳酸氢盐和有机物形式存在。水体中有机物含量是水质的重要指标,常用总有机碳衡量(总有机碳=![]() )。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。
)。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。

步骤1:量取50 mL水样,加入足量硫酸,加热,通N2,并维持一段时间(装置如图,夹持类仪器省略)。
步骤2:再向水样中加入过量的K2Cr2O7溶液(可将有机物中的碳元素氧化成CO2),加热,充分反应,生成的CO2完全被100mL 0.206 mol·L-1的Ba(OH)2溶液吸收。
步骤3:将吸收CO2后的浊液过滤并洗涤沉淀,再将洗涤得到的滤液与原滤液合并,加水配制成500mL溶液。量取25.00mL溶液于锥形瓶中,加入几滴酚酞试剂,并滴加0.05mol·L-1的H2C2O4溶液,发生反应:Ba(OH)2+H2C2O4===BaC2O4↓+2H2O 恰好完全反应时,共消耗H2C2O4溶液20.00 mL。
(1)步骤1的目的是____。
(2)用H2C2O4溶液滴定至终点时,溶液颜色变化是____。
(3)计算水样的总有机碳(以mg·L-1表示),并写出计算过程。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 的分子式均为 C8H8,下列说法正确的是
的分子式均为 C8H8,下列说法正确的是
A. a、b、c 均可与酸性高锰酸钾溶液反应
B. a、b、c 的二氯代物均只有 3 种
C. a 的同分异构体中除 b、c 外,还有可与溴水反应的物质
D. a、b、c 中只有 b、c 的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和实验现象所得到的实验结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向氯仿样品中加入硝酸银溶液 | 有白色沉淀产生 | 样品已变质 |
C | 向待测液中依次滴入氯水和KSCN溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料,其制备工艺流程如下图所示:
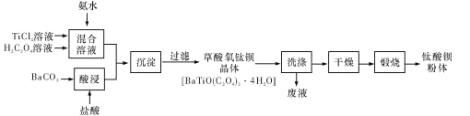
(1)镁的碳化物常见的有MgC2和Mg2C3两种,它们均极易与水发生反应。写出MgC2发生水解反应的化学方程式:_____;Mg2C3的电子式为_____。
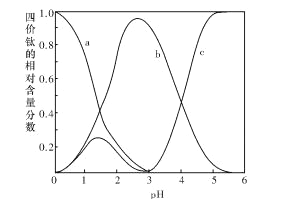
(2)“混合溶液”环节,钛元素在不同pH下主要以种形式存在,如上图所示。实际制备工艺中,先用氨水调节混合溶液的pH于2.5~3之间,再进行“沉淀”,则上图中曲线a对应钛的形式为______填化学符号);写出“沉淀”时的离子方程式:_____。
(3)草酸氧钛钡晶体经蒸馏水数次洗涤后,证明它已被洗涤干净的实验方案为_____。
(4)工业上TiCl4和BaCO3通常用如下方法制备:
①先将金红石(TiO2)与过量焦炭混合,再通入Cl2)并加热到900℃制取TiCl4。请写出该法制备TiCl4的化学方程式:_____。
②BaCO3是将重晶石(主要成分为BaSO4)浸泡在Na2C03溶液中足够长时间来制备。请问Na2CO3溶液的浓度至少要大于_____mol/L才能开始转化。(已知常温下:![]()
![]() ,略CO32-的水解)。
,略CO32-的水解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
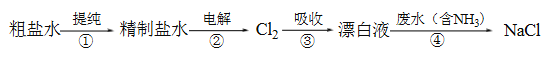
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com