
【题目】下列事实中不能用平衡移动原理解释是( )
A. 密闭、低温是存放氨水的必要条件
B. 实验室常用排饱和食盐水法收集氯气
C. 打开汽水瓶时,有大量气泡冒出
D. 已知合成氨的反应为N2(g)+3H2(g)2NH3(g)△H=﹣92.4 kJ/mol,工业上采用较高温度和使用催化剂以提高氨气的产率
【答案】D
【解析】
平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用。
A.氨水中存在NH3+H2ONH3![]() H2ONH4++OH-,一水合氨不稳定,升高温度易分解,所以需要密封、低温保存,可以用平衡移动原理解释,故A不选;
H2ONH4++OH-,一水合氨不稳定,升高温度易分解,所以需要密封、低温保存,可以用平衡移动原理解释,故A不选;
B.氯气和水反应存在Cl2+H2OHCl+HClO,食盐水中含有氯离子抑制氯气溶解,所以可以采用排饱和食盐水的方法收集氯气,可以用平衡移动原理解释,故B不选;
C.因溶液中存在二氧化碳的溶解平衡,打开汽水瓶后,压强减小,二氧化碳逸出,能用平衡移动原理解释,故C不选;
D.催化剂只改变化学反应速率不影响平衡移动,所以不能用平衡移动原理解释,故D选。
故选D。


科目:高中化学 来源: 题型:
【题目】取一定物质的量浓度的NaOH溶液100 mL,向其中通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积 (标准状况)与所加HCl溶液的体积之间关系如图所示,请回答:

(1)A溶液中的溶质_________。(用化学式表示)
(2)通入的CO2的体积(标准状况)为_______ mL。
(3)NaOH溶液的物质的量浓度_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂、漂白剂,主要用于亚麻、纸浆等漂白。NaClO2在溶液中可生成ClO2、HClO2、ClO2-、Cl-等含氯微粒,经测定,25 ℃时各组分含量随pH变化情况如图所示(部分没有画出)。则下列分析不正确的是

A. 亚氯酸钠在碱性条件下较稳定
B. 25 ℃时,HClO2的电离平衡常数Ka=10-6
C. 25 ℃,pH=3时NaClO2溶液中c(Na+)+c(H+)=c(ClO2-)+c(OH-)
D. 等浓度的HClO2溶液和NaClO2溶液等体积混合的溶液中(pH<7):c(ClO2-)>c(Na+)>c(HClO2)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
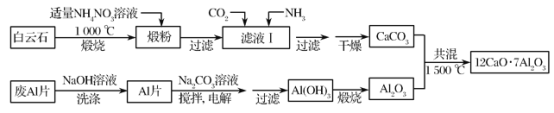
(1)煅粉主要含MgO和________,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,若溶液Ⅰ中c(Mg2+)小于5×10-6mol·L-1,则滤液pH大于________[Mg(OH)2的Ksp=5×10-12];该工艺中不能用(NH4)2SO4代替NH4NO3,原因是______________。
(2)滤液Ⅰ中的阴离子有________(忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成________,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为_________。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式________。
(5)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其他离子不参与电极反应,放电时负极Al的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一种同位素X原子的质量数为A,它与2H原子组成2HmX分子,此分子含N个中子,在a g 2HmX中所含电子的物质的量是
A. ![]() (A-N+m) molB.
(A-N+m) molB. ![]() (A-N) mol
(A-N) mol
C. ![]() (A-N+m) molD.
(A-N+m) molD. ![]() (A-N+2m) mol
(A-N+2m) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:Al3++4NH3·H2O![]() AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B. 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-![]() CaCO3↓+H2O
CaCO3↓+H2O
C. 碳酸钙溶于醋酸:CaCO3+2H+![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
D. 氯化亚铁溶液中通入氯气:2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下:
部分氢氧化物沉淀的pH如下表

沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH2 |
开始沉淀pH (离子初始浓度0.01 mol/L) | 4.3 | 2.3 | 10.4 |
完全沉淀pH (离子浓度<10-5 mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题:
(1)加入盐酸时,氧化铝发生反应的离子方程式为_________。
(2)实验室进行步骤②的操作名称为________,其使用到的玻璃仪器是 。
(3)固体A的化学式为_______,物质C的化学式为_______;溶液中的Na+、Ca2+、Mg2+是在步骤________(填序号)中分离出去的。
(4)步骤③调节pH的数值范围为_______,步骤④调节pH的数值范围为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应aM(g)+bN(g)![]() cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如下图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如下图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是

A. 同温同压同z时,加入催化剂,平衡时Q的体积分数增加
B. 同压同z时,升高温度,平衡时Q的体积分数增加
C. 同温同z时,增加压强,平衡时Q的体积分数增加
D. 同温同压时,增加z,平衡时Q的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
二 |
|
| ||||||
三 |
|
|
|
|
|
| ||
四 |
(1)9种元素中,化学性质最不活泼的是______,原子结构示意图为____________。
(2)这些元素中,最高价氧化物的水化物中碱性最强的碱是__________,写出元素![]() 的单质与其反应的离子方程式:___________________________________。
的单质与其反应的离子方程式:___________________________________。
(3)最高价氧化物是两性氧化物的元素是______ ,写出它的氧化物与NaOH溶液反应的化学反应方程式: ____________________________________ 。
(4)用电子式表示元素![]() 和
和![]() 组成的化合物的形成过程 _____________________________,该化合物属于 ______ (填“共价”或“离子”
组成的化合物的形成过程 _____________________________,该化合物属于 ______ (填“共价”或“离子”![]() 化合物。
化合物。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com