
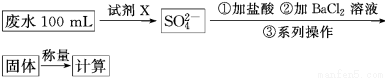
某废水样品中含有一定量的K+、HCO3—、SO32—,甲、乙两研究小组欲测定其中SO32—的浓度。
甲组方案:
乙组方案:
①用烧杯盛取废水适量,加适量活性炭除色;过滤,取滤液。
②精确量取20.00 mL过滤后的废水试样,用0.1 mol·L-1紫色KMnO4(H2SO4酸化)溶液进行滴定(有关反应为2MnO4—+5SO32—+6H+=2Mn2++5SO42—+3H2O)。
③记录数据,计算。
(1)甲组方案中的“试剂X”可选用________。
a.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液
b.0.5 mol·L-1 KOH溶液
c.新制氯水
d.NaI溶液
(2)甲组方案中,加入试剂X后生成SO42—的离子方程式为________________。
(3)甲组方案中,第③步的“系列操作”包含的操作名称依次为__________________。
(4)为乙组方案设计的下列滴定方式中,最合理的是________(填字母序号),达到滴定终点时可观察到的现象是__________________。
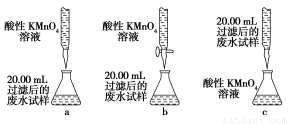
(1)c
(2)SO32—+Cl2+H2O=SO42—+2Cl-+2H+
(3)过滤、洗涤、干燥
(4)b 溶液由无色变为紫红色
【解析】(1)加入试剂X后所得溶液中含有SO42—,故试剂X为氧化剂,排除选项b、d;由于最后需要测定SO42—,故不能用含有SO42—的高锰酸钾溶液,排除a;新制氯水具有氧化性,且对后续定量实验没有影响,合理选项为c。(2)新制氯水中含有Cl2,能够将SO32—氧化为SO42—,而本身被还原为Cl-。(3)经第①步、第②步操作后产生沉淀,故第③步操作为过滤,然后对滤渣进行洗涤,干燥。(4)高锰酸钾具有强氧化性,容易腐蚀碱式滴定管的橡胶管,故高锰酸钾应该用酸式滴定管盛装,a错;乙组方案第②步中提示“精确量取20.00 mL过滤后的废水试样,用0.1 mol·L-1紫色KMnO4(H2SO4酸化)溶液进行滴定”,故锥形瓶中应盛装废水试样,而滴定管中应该盛高锰酸钾溶液,c错。


科目:高中化学 来源:2014年高考化学一轮复习课后规范训练2-3练习卷(解析版) 题型:填空题
消毒剂在生产生活中有极其重要的作用,开发具有广普、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2C.ClO2 D.O3
(2)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为________,H2O2被称为“绿色氧化剂”的理由是____________________________________
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为________。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是__________________(用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-3练习卷(解析版) 题型:填空题
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
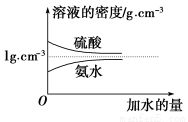
| 溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为________mol·L-1。
(3)物质的量浓度为c2 mol·L-1的氨水与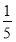 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________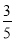 c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-2练习卷(解析版) 题型:填空题
(1)由三个原子构成的某气体分子,其摩尔质量为M g/mol,该气体的体积为V L(标准
状况),设阿伏加德罗常数的值为NA,则:
①该气体的物质的量为________mol;
②该气体中所含的原子总数为________个;
③该气体在标准状况下的密度为________g/L;
④该气体的一个分子的质量为________g。
(2)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为________,推断的依据为______________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-2练习卷(解析版) 题型:选择题
工业上将氨气和空气的混合气体通过铂?铑合金网发生氨氧化反应,若
有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为( )

查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-1练习卷(解析版) 题型:选择题
某无色溶液中含有大量Na2SO4、Na2CO3、NaOH,为验证其中所含的阴离子,若限定只取一次待测液,则加入试剂顺序正确的是( )
A.酚酞、BaCl2、盐酸 B.BaCl2、盐酸、酚酞
C.BaCl2、酚酞、盐酸 D.酚酞、盐酸、BaCl2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-1练习卷(解析版) 题型:选择题
下列由相关实验现象所推出的结论正确的是( )
A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42—
C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型四 离子反应型专题练习卷(解析版) 题型:选择题
下列离子方程式正确的是( )
A.小苏打溶液中加入少量石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.稀硝酸中加入少量铁粉:Fe+2H++NO3-=Fe3++NO↑+H2O
C.溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-

查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型十二 仪器组合型专题练习卷(解析版) 题型:选择题
下图所示的实验装置不能完成实验目的是( )
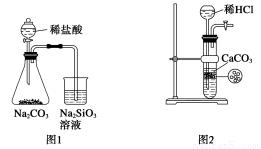
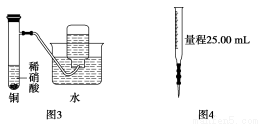
A.图1为证明非金属性强弱:Cl>C>Si
B.图2为制备少量CO2并控制反应
C.图3为制备并收集少量NO气体
D.图4量取0.10 mol·L-1 KOH溶液20.00 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com