
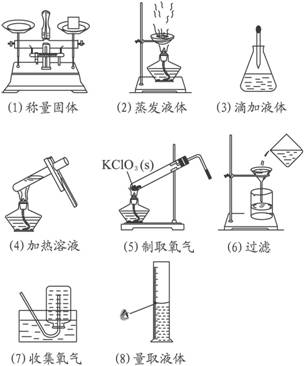
(1)称量物与砝码位置颠倒。用托盘天平称量固体时,左边放称量物,右边放砝码,即通常所说“左物右砝”。同时还必须注意潮湿的、易潮解的或腐蚀性的药品必须放在玻璃器皿中称量,其他固体药品应先在天平两托盘内各放一张同样大小的纸片后再称量。
(2)未用玻璃棒。蒸发液体要用玻璃棒搅拌,防止由于局部温度过高造成液滴飞溅。
(3)滴管不能深入到锥形瓶内。滴加液体时滴管应垂直悬空在锥形瓶(或烧杯、试管等)上方,不要接触器皿壁,以免玷污滴管或造成试剂的污染。
(4)试管中的液体超过了试管的![]() ,不能用酒精灯的内焰加热,试管夹的位置也不对。
,不能用酒精灯的内焰加热,试管夹的位置也不对。
(5)试管口不应向上倾斜,且试管内的药剂不能仅是KClO3固体。制取O2的试管口应略向下倾斜,以防加热固体时产生的水或吸附水流向试管的底部,引起试管爆裂;另外,如果仅加热KClO3制O2,反应速率太慢,必须加入催化剂,如MnO2粉末。
(6)没用玻璃棒引流,漏斗口的下端没有紧靠烧杯内壁。过滤时,要“一贴、二低、三靠”。“一贴”是指滤纸紧贴漏斗的内壁;“二低”是指滤纸的边缘应低于漏斗口,漏斗里的液体要低于滤纸的边缘;“三靠”是指倾倒液体的烧杯尖口要紧靠玻璃棒,玻璃棒的末端要轻靠三层滤纸的一边,漏斗下端的管口要紧靠烧杯的内壁。注意一次过滤后滤液仍浑浊,应再过滤一次。
(7)错在导气管伸到了瓶底。用排水法收集气体时导气管伸到瓶口处即可。
(8)错在仰视。观察刻度时,量筒要放平,眼睛应平视凹液面的最底处并与之相切处。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
 (2011?浙江)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(2011?浙江)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol?L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为:| c(H2)?c(CO) |
| c(H2O) |
| c(H2)?c(CO) |
| c(H2O) |
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol?L-1) | 0.10 | a | 0.026 | 0.0065 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com