
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)⇌2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量).下列判断正确的是()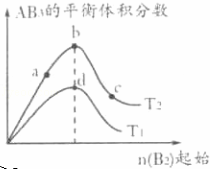
A. 若T2>T1,达到平衡时b、d点的反应速率为vd>vb
B. 若T2>T1,则正反应一定是放热反应
C. 达到平衡时A2的转化率大小为b>a>c
D. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a
考点: 化学平衡的影响因素.
专题: 化学平衡专题.
分析: A、温度越高,反应速率 越快,当T2>T1时,vd<vb;
B、由图可知,T2时AB3的体积分数大于T1时AB3的体积分数,当T2>T1时,则说明升高温度平衡正向移动,即正反应为吸热反应;
C、在可逆反应中增加一种反应物的浓度可以提高另一种物质的转化率,随着B2的量的增加,A2的转化率逐渐增大,即c>b>a;
D、在可逆反应中,随着B2的量的增加,A2的转化率逐渐增大,生成的AB3的物质的量逐渐增大.
解答: 解:A、温度越高,反应速率 越快,当T2>T1时,vd<vb,故A错误;
B、由图可知,T2时AB3的体积分数大于T1时AB3的体积分数,当T2>T1时,则说明升高温度平衡正向移动,即正反应为吸热反应,故B错误;
C、在可逆反应中增加一种反应物的浓度可以提高另一种物质的转化率,随着B2的量的增加,A2的转化率逐渐增大,即c>b>a,故C错误;
D、在可逆反应中,随着B2的量的增加,A2的转化率逐渐增大,生成的AB3的物质的量逐渐增大,故D正确;
故选D.
点评: 本题主要考查影响化学平衡移动的因素以及影响化学反应速率的因素,中等难度,解题关键在于仔细审题,尤其是图象.


科目:高中化学 来源: 题型:
把0.05molNaOH固体分别加入下列100mL溶液中,溶液的导电能力变化不大的是()
A. 自来水 B. 0.5mol•L﹣1KOH溶液
C. 0.5mol•L﹣1醋酸 D. 0.5mol•L﹣1NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关系不正确的是( )
|
| A. | 原子半径:K>Na>Mg>N | B. | 酸性:HNO3>H3PO4>H2SiO3 |
|
| C. | 稳定性:HF<H2O<H2S | D. | 酸性:HClO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)⇌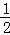 N2(g)+CO2(g)△H=﹣373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是()
N2(g)+CO2(g)△H=﹣373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是()
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z为三种气体.把 a molX和 b molY充入一密闭容器中.发生反应X+2Y⇌2Z 达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为()
A. [ ]×100% B. [
]×100% B. [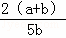 ]×100% C. [
]×100% C. [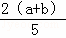 ]×100% D. [
]×100% D. [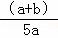 ]×100%
]×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
T℃时,有甲、乙两个密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6mol A和3mol B,发生反应如下:3A(g)+bB(g)⇌3C(g)+2D(g)△H<0; 4min时甲容器内的反应恰好达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L; t min时乙容器内的反应达平衡,根据题给信息回答下列问题:
(1)甲容器中反应的平均速率v(B)= ,化学方程式中计量数b= .
(2)乙容器中反应达到平衡时所需时间t 4min(填“大于”、“小于”或“等于”).
(3)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是AC.
A.保持温度不变,增大甲容器的体积至2L
B.保持容器体积不变,使甲容器升高温度
C.保持容器压强和温度都不变,向甲中加入一定量的A气体
D.保持容器压强和温度都不变,向甲中加入一定量的B气体
(4)写出平衡常数表达式K= ,并计算在T℃时的化学平衡常数K .
查看答案和解析>>
科目:高中化学 来源: 题型:
关于浓度均为0.1mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是()
A. c(NH+4):③>①
B. 水电离出的c(H+):②>①
C. ①和②等体积混合的溶液:c(H+)=c(OH﹣)+c(NH3•H2O)
D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O72﹣和CrO42﹣,它们会对人类及生态系统产生很大的伤害,必须进行处理.某工厂使用还原沉淀法处理,该法的工艺流程为:CrO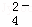
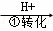 CrO
CrO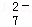
 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42﹣(黄色)+2H+⇌Cr2O72﹣(橙色)+H2O
(1)若平衡体系的pH=12,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 .
a.Cr2O72﹣的浓度不变 b.Cr2O72﹣和CrO42﹣的浓度相同c.2v(Cr2O72﹣)=v(CrO42﹣)d.溶液的颜色不变
(3)第②步反应中,还原剂为 .
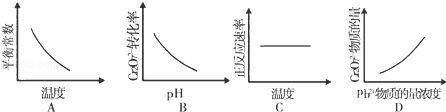
(4)电镀废液中Cr2O72﹣还可通过下列反应转化:
Cr2O72﹣(aq)+2Pb2+(aq)+H2O(l)⇌2PbCrO4(s)+2H+(aq)△H<0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是A
(5)泡沫灭火器中所用的原料是小苏打(NaHCO3)和硫酸铝,写出泡沫灭火器中当两者混合时发生反应的离子方程式 .
(6)已知NaHSO3溶液显酸性,其原因是 (用离子方程式和相关语言说明)
查看答案和解析>>
科目:高中化学 来源: 题型:
CH3﹣CH3→CH2=CH2+H2,有关化学键的键能如下:
化学键 C﹣H C=C C﹣C H﹣H
键能(kJ/mol) 414.4 615.3 347.4 435.3
计算该反应的反应热. kJ/mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com