
| 选项 | 实验现象 | 结论 |
| A | 把相同大小的一块铝和镁分别投入相同浓度的盐酸中,镁溶解有气泡产生,而铝没有任何变化 | 镁的金属性比铝强 |
| B | 取一块铝箔,用酒精灯点燃,铝箔只熔化成液体 | 铝不易燃烧 |
| C | 向氯化铵溶液中投入一铝片,铝上产生大量气泡 | 该气体是氢气 |
| D | 向氯化铝溶液中逐滴滴加NaOH溶液至过量,先产生沉淀,后沉淀逐渐溶解,最后沉淀完全消失 | 氢氧化铝能溶解于强碱溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Al表面可能有致密的氧化膜,与酸反应不生成气体;
B.铝箔只熔化成液体,与生成的氧化铝熔点高有关;
C.氯化铵溶液显酸性;
D.氢氧化铝为两性氢氧化物,能与NaOH反应.
解答 解:A.Mg、Al体积大小相同,酸浓度相同,但Al表面可能存在氧化膜,干扰金属与酸反应,则不能利用现象得出结论,故A错误;
B.铝箔只熔化成液体,与生成的氧化铝熔点高有关,高熔点的氧化铝包裹在Al的外面,则铝不易燃烧,故B正确;
C.氯化铵溶液显酸性,则与Al反应生成氢气,故C正确;
D.氢氧化铝为两性氢氧化物,能与NaOH反应,则向氯化铝溶液中逐滴滴加NaOH溶液至过量,先产生沉淀,后沉淀逐渐溶解,最后沉淀完全消失,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握金属活泼性比较、盐类水解、物质的性质为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:填空题
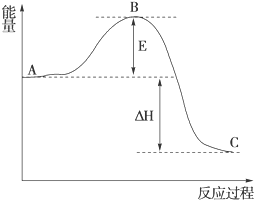 (1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.
(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件,该小组同学为探究中毒原因进行了如下实验:
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件,该小组同学为探究中毒原因进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 发展阶段 | 原子结构模型 | 重要科学家 | 提出模型的主要依据 |
| (1) | 近代原子论 | 气体实验与观察 | |
| (2) | 汤姆孙 | ||
| (3) | 原子行星模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积一定相等 | B. | 分子数一定相等 | ||
| C. | 质量一定相等 | D. | 物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com