
【题目】化学平衡问题研究对象主要是
A.化学反应B.可逆反应C.离子反应D.气态物质的反应
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】合成氨工业上常用下列方法制备H2:
方法I:C(s)+2H2O(g) ![]() CO2(g)+2H2(g)
CO2(g)+2H2(g)
方法Ⅱ:CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知
①C(s,石墨)+O2(g)=CO2(g) △H1=一394 kJ·mol一1
②2C(s,石墨)+O2(g)=2CO(g) △H2=一222 kJ·mol-1
③2H2(g)+O2(g)= 2H2O(g) △H3=一484 kJ·mol-1
试计算25℃时由方法Ⅱ制备1 000 g H2所放出的能量为______________。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应C(s)+2H2O(g) ![]() CO2(g)+2H2(g)。其相关数据如下表所示:
CO2(g)+2H2(g)。其相关数据如下表所示:

①T1____T2(填“>”“=”或“<”);T1℃时,该反应的平衡常数K=______________。
②乙容器中,当反应进行到1.5 min时,H2O(g)的物质的量浓度范围是__________。
③在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是____________(填序号)。
A.V逆(CO2)=2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均摩尔质量保持不变
(3) 现有0.175 mol/L 醋酸钠溶液500 mL(已知醋酸的电离平衡常数K=1.75×10-5)。
①下列图像能说明醋酸钠的水解反应在t1时刻达到平衡的是________(填序号,下同)。
A.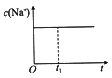 溶液中c(Na+)与反应 时间t的关系
溶液中c(Na+)与反应 时间t的关系
B. CH3COO一的水解速率与反应时间t的关系
CH3COO一的水解速率与反应时间t的关系
C . 溶液的pH与反应时间t的关系
溶液的pH与反应时间t的关系
D. K与反应时间t的关系
K与反应时间t的关系
②在醋酸钠溶液中加入下列少量物质,水解平衡向正反应方向移动的有_____________ 。
A.冰醋酸B.纯碱固体c.醋酸钙固体D.氯化铵固体
(4)在醋酸钠溶液中加入少量冰醋酸后,溶液中微粒浓度的关系式能成立的有________。
A.c(CH3COO一)+c(CH3COOH)>c(Na+)
B.c(Na+)> c(CH3COO一)>c(H+)>c(OH一)
C.c(CH3COO一)> c(Na+)> c(H+)>c(OH一)
D.c(CH3COO一)>c c(H+)>c(OH一)> c(Na+)
(5)欲配制0.175 mol/L醋酸钠溶液500 mL,可采用以下两种方案:
方案一:用托盘天平称取_________g无水醋酸钠,溶于适量水中,配成500 mL溶液。
方案二:用体积均为250 mL且浓度均为_____________的醋酸与氢氧化钠溶液混合而成(设混合后的体积等于混合前两者体积之和)。在室温下,0.175 mol/L醋酸钠溶液的pH约为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用或操作正确的是( )
A. 烧杯、烧瓶、锥形瓶均可加垫石棉网加热
B. 试剂瓶可以用于存放、溶解、稀释药品
C. 用容量瓶配制溶液时,加入蒸馏水需要用玻璃棒引流,加至刻度线
D. 用滴定管量取液体时,开始读数和最后读数均俯视,则量取的体积准确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 63%的浓 HNO3 (其密度为 1.4 g·mL -1)配制 240 mL 0.50 mol·L-1 稀 HNO3,若实验仪器有:
A.10 mL 量筒 B.50 mL 量筒 C.托盘天平 D.玻璃棒 E.100 mL 容量瓶 F.250 mL 容量瓶 G.500 mL 容量瓶 H.胶头滴管 I.200mL 烧杯
(1)此浓硝酸的物质的量浓度为_____mol·L -1。
(2)应量取 63%的浓硝酸_____mL,应选用_____(填仪器的字母编号)。
(3)实验时还需选用的仪器有 D、I、______(填序号)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)______。
①量取浓硝酸的量筒用蒸馏水洗涤 2~3 次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017·北京]TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
![]()
资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | 69 | 25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol1
2C(s)+O2(g)=2CO(g) ΔH2=220.9 kJ·mol1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。

③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
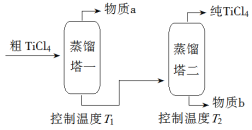
物质a是______________,T2应控制在_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅰ]Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以![]() 形式存在,写出相应反应的离子方程式__________________。
形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40 ℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中![]() ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使![]() 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中![]() ,此时是否有Mg3(PO4)2沉淀生成? (列式计算)。FePO4、Mg3(PO4)2的Ksp分别为
,此时是否有Mg3(PO4)2沉淀生成? (列式计算)。FePO4、Mg3(PO4)2的Ksp分别为![]() 。
。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.化学反应中既有物质变化又有能量变化
B.电池是由电能转化为化学能的装置
C.焓增熵减的反应一定可以自发进行
D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、HCN与K2CO3在一定条件下发生如下反应:
Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为___________________。
(2)配合物K4Fe(CN)6的中心离子是____________,该离子价电子的基态电子排布图为____________。
(3)lmol HCN分子中含有σ键的数目为____________,HCN分子中碳原子轨道杂化类型是____________,与CN-互为等电子体的阴离子是____________。
(4)K2CO3中阴离子的空间构型为____________,其中碳原子的价层电子对数为____________。
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞有__________个氢键,若氢键键长为d nm,则晶体密度(g/cm3)计算式为____________(用NA表示阿伏伽德罗常数的值)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com