
��14�֣���������Ȼ���еIJ���ѭ����ϵ���¡�
��1��H2S�ڿ����п���ȼ�ա�
��֪�� 2H2S(g) + O2(g)  2S(s) + 2H2O(g) ��H= ��442.38 kJ/mol ��
2S(s) + 2H2O(g) ��H= ��442.38 kJ/mol ��
S(s) + O2(g)  SO2(g) ��H=��297.04 kJ/mol ��
SO2(g) ��H=��297.04 kJ/mol ��
H2S(g)��O2(g)��Ӧ����SO2(g)��H2O(g)���Ȼ�ѧ����ʽ�� ��
��2��SO2�Ǵ�����Ⱦ���ˮ�������õ�����SO2����������������¡�
�� SO2���ں�ˮ����H2SO3��H2SO3���ջ�����SO32��������뷽��ʽ�� ��
�� SO32�����Ա���ˮ�е��ܽ�������ΪSO42������ˮ��pH�� ������ߡ� �������䡱���͡�����
�� Ϊ������ˮ��pH���ɼ������ʵĺ�ˮ��ʹ���е�HCO3�����뷴Ӧ���䷴Ӧ�����ӷ���ʽ�� ��
�� ��������Ӧ��ͬʱ��Ҫ���������������ԭ���� ��
��3����Ȼ��ر���ԭ��ͭ�����ᆳ�������������ú���CuSO4��Һ���������������������ܵ�ZnS������ת��Ϊͭ����CuS�����û�ѧ�����ʾ��ZnSת��ΪCuS�Ĺ��̣� ��
��4��SO2��O2��H2SO4��Һ�п��Թ���ԭ��أ��为����Ӧʽ�� ��
��14�֣�ÿ��2�֣�
��1��2H2S(g)+3O2(g)  2SO2(g)+2H2O(g) ��H= ��1036.46 kJ/mol ������ʽ�ͼ����1�֣�
2SO2(g)+2H2O(g) ��H= ��1036.46 kJ/mol ������ʽ�ͼ����1�֣�
��2���� H2SO3 HSO3��+ H+ HSO3��
HSO3��+ H+ HSO3�� SO3 2��+ H+ ��ÿ��1�֣�
SO3 2��+ H+ ��ÿ��1�֣�
�� ����
�� HCO3 ��+ H+  CO2 ��+ H2O������1�֣���ƽ1�֣�
CO2 ��+ H2O������1�֣���ƽ1�֣�
���������ˮ���ܽ�������SO32-������ΪSO42-��������ƽ��H2SO3 HSO3��+ H+ HSO3��
HSO3��+ H+ HSO3�� SO3 2��+ H+ �����ƶ���1�֣�����߶��������ת���ʣ�ͬʱ�ӿ췴Ӧ���ʵ����ã�1�֣���
SO3 2��+ H+ �����ƶ���1�֣�����߶��������ת���ʣ�ͬʱ�ӿ췴Ӧ���ʵ����ã�1�֣���
��3��
��4��������SO2 - 2e��+ 2H2O  SO4 2��+ 4H+������1�֣���ƽ1�֣�
SO4 2��+ 4H+������1�֣���ƽ1�֣�
���������������1�����ݸ�˹���ɵ�Ŀ�귽��ʽ=��+2���ڣ�����H2S(g)��O2(g)��Ӧ����SO2(g)��H2O(g)���Ȼ�ѧ����ʽ��2H2S(g)+3O2(g) 2SO2(g)+2H2O(g) ��H= ��1036.46 kJ/mol
2SO2(g)+2H2O(g) ��H= ��1036.46 kJ/mol
��2���������������ᣬ�ֲ������SO3 2�������뷽��ʽ��H2SO3 HSO3��+ H+ HSO3��
HSO3��+ H+ HSO3�� SO3 2��+ H+
SO3 2��+ H+
��SO32�����Ա���ˮ�е��ܽ�������ΪSO42����������ǿ�ᣬ��Һ�е�������Ũ������pH���ͣ�
�����ʵĺ�ˮ�����ԣ���HCO3����Ӧ���ɶ�����̼��ˮ�����ӷ���ʽΪHCO3 ��+ H+  CO2 ��+ H2O
CO2 ��+ H2O
�ܺ�ˮ�������õ�����SO2���������������������������ߺ�ˮ�еĺ���������SO32-������ΪSO42-��������ƽ��H2SO3 HSO3��+ H+ HSO3��
HSO3��+ H+ HSO3�� SO3 2��+ H+ �����ƶ�����߶��������ת���ʣ�ͬʱ�ӿ췴Ӧ���ʵ����ã�
SO3 2��+ H+ �����ƶ�����߶��������ת���ʣ�ͬʱ�ӿ췴Ӧ���ʵ����ã�
��3��CuS��ZnS�����ܣ���п����ZnS(s)  Zn2+(aq)+S2��(aq)ƽ�⣬����������ͭ��Һʱ��S2����Cu2+�������CuS������ʹ�ܽ�ƽ�������ƶ�������ZnSȫ��ת��ΪCuS���û�ѧ�����ʾΪ
Zn2+(aq)+S2��(aq)ƽ�⣬����������ͭ��Һʱ��S2����Cu2+�������CuS������ʹ�ܽ�ƽ�������ƶ�������ZnSȫ��ת��ΪCuS���û�ѧ�����ʾΪ
��4����������������Ӧ��Ԫ�ػ��ϼ����ߣ������Ƕ��������ڸ���������Ӧ��������������ӣ��缫��ӦʽΪSO2 - 2e��+ 2H2O  SO4 2��+ 4H+
SO4 2��+ 4H+
���㣺�����˹���ɵ�Ӧ�ã����뷽��ʽ����д���ܽ�ƽ����ƶ����绯ѧԭ����Ӧ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ú�������Ǹ�Ч����������ú̿����Ҫ;��֮һ��
(1)��250C 101kPaʱ��H2��O2��������1mol H2O(g)�ų�241.8kJ�����������Ȼ�ѧ����ʽΪ
___________
��֪: ��C(s)��O2(g)�TCO2(g) ��H����393.5kJ/mol
��CO(g)��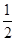 O2(g)�TCO2(g) ��H����283.0kJ/mol
O2(g)�TCO2(g) ��H����283.0kJ/mol
��̿��ˮ������Ӧ�ǽ�����ú��Ϊ����ȼ�ϵķ�����C(s)��H2O(g)�TCO(g)��H2(g) ��H=____kJ/mol
(2) CO������H2O(g)��һ��������Ӧ: CO(g)��H2O(g) CO2(g)��H2(g) ��H��0�ں����ܱ������У���ʼʱn(H2O)=0.20mol��n(CO)��0.10 mol,��8000Cʱ�ﵽƽ��״̬��K��1.0����ƽ��ʱ��������CO��ת������_____________(����������һλС��)��
CO2(g)��H2(g) ��H��0�ں����ܱ������У���ʼʱn(H2O)=0.20mol��n(CO)��0.10 mol,��8000Cʱ�ﵽƽ��״̬��K��1.0����ƽ��ʱ��������CO��ת������_____________(����������һλС��)��
(3) ��ҵ�ϴ�ú������Ļ�����з����H2�����а��ĺϳɣ���֪��Ӧ��ӦN2(g)��3H2(g 2NH3(g)����H��0���ڵ��������½��У��ı�������Ӧ��������I��II��III����ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��
2NH3(g)����H��0���ڵ��������½��У��ı�������Ӧ��������I��II��III����ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��
��N2��ƽ����Ӧ����v1(N2)��vII(N2)��vIII(N2)�Ӵ�С���д���Ϊ________��
���ɵ�һ��ƽ��ڶ���ƽ�⣬ƽ���ƶ��ķ��� ��________����ȡ�Ĵ�ʩ��________��
�۱Ƚϵ�II�η�Ӧ�¶�(T2)�͵�III�η�Ӧ�ٶȣ�T3)�ĸߵͣ�T2________T3�����=��<���жϵ�������________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�о����仯�������������Ҫ���塣
��1��Cu2S�ڸ��������·������·�Ӧ��
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) �SH=��773kJ/mol
���÷�Ӧ��1.2mol����ת��ʱ,��Ӧ�ͷų�������Ϊ kJ��
��2�����Ṥҵ�������漰��Ӧ��2SO2(g)+O2(g) 2SO3(g)��SO2��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
2SO3(g)��SO2��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
��ѹǿ��P1 P2�����������=����<������
��ƽ�ⳣ����A�� B�㣨���������=����<������
��200���£���һ������SO2��O2�������������ܱ������У���10min���������и����ʵ����ʵ���Ũ�����±���ʾ:
| ���� | SO2 | O2 | SO3 |
| Ũ�ȣ�mol/L�� | 0.4 | 1.2 | 1.6 |
 ������֪���¶���H2SO3�ĵ��볣����Ka1=1.0��10-2 mol/L��Ka2=6.0��10-3 mol/L��
������֪���¶���H2SO3�ĵ��볣����Ka1=1.0��10-2 mol/L��Ka2=6.0��10-3 mol/L���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��14�֣���ѧ����Դ����������������ʮ����Ҫ�����á�
��1���̲��ں��Ŀ�ȼ���Ǹ�ѹ���γɵ��������ļ���ˮ������壮����֮Ϊ��δ����Դ������25�桢101 kPa�£�1g������ȫȼ�����ɺ�Һ̬ˮʱ����55.6 kJ������ȼ�յ��Ȼ�ѧ����ʽΪ ______����ͬ�����£�356 g��ȼ��������ʽΪCH4��9H2O��Mr��178���ͷŵļ���������ȫȼ������CO2��Һ̬ˮ���ų�������Ϊ_______kJ��
��2��������(CH3OCH3)����ɫ���壬����Ϊһ��������Դ��������ࡢ��Ч���������ܡ��ɺϳ���(���ΪH2��CO��������CO2)ֱ���Ƹ������ѣ����е���Ҫ���̰��������ĸ���Ӧ��
�״��ϳɷ�Ӧ��
����CO��g��+2H2��g���TCH3OH��g�� ��H1����90.1kJ?mol-1
����CO2��g��+3H2��g���TCH3OH��g��+H2O��g�� ��H2����49.0kJ?mol-1
ˮú���任��Ӧ������CO��g��+H2O��g���TCO2��g��+H2 ��g�� ��H3����41.1kJ?mol-1
�����Ѻϳɷ�Ӧ��������2CH3OH��g���TCH3OCH3��g��+H2O��g����H4����24.5kJ?mol-1
�ٷ��������Ѻϳɷ�Ӧ(iv)����COת���ʵ�Ӱ��___________________________________��
����H2��COֱ���Ʊ������ѣ���һ����Ϊˮ���������Ȼ�ѧ����ʽΪ��__________________�����ݻ�ѧ��Ӧԭ������������ѹǿ��ֱ���Ʊ������ѷ�Ӧ��Ӱ��_________________________________��
��3��������ֱ��ȼ�ϵ�ؾ��������졢Ч�ʸߵ��ŵ㡣�������Ϊ���ԣ�������ֱ��ȼ�ϵ�صĸ�����ӦΪ______________________��һ�������ѷ��Ӿ����绯ѧ���������Բ���________���ӵĵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��14�֣��о������仯���������Ҫ���塣
��l����֪��
Ag2O��s��+2HC1��g�� 2AgC1��s��+H2O��1�� ��H1=��324��4 kJ��mo1��1
2Ag��s��+1/2O2��g�� Ag2O��s�� ��H2=��30��6 kJ��mo1��1
H2��g��+C12��g�� 2HC1��g�� ��H3=��184��4 kJ����mo1��1
2H2��9��+O2��g�� 2H2O��1�� ��H4=��571��2 l��mo1��1
д�������������ɹ����Ȼ������Ȼ�ѧ����ʽ________��
��2�����������γ���Fe(NO3)3��Һʴ�̣�д��Fe3+��Ag��Ӧ�����ӷ���ʽ___ _��Ҫ�ж�Fe(NO3)3��Һ��NO3���Ƿ�������ʴ���з�����Ӧ����ȡ ��������Һ��Ȼ��������Ƿ���Ag������Ӧ���ж���
��3����п���Ե�صĵ������ҺΪKOH��Һ���ŵ�ʱ������Ag2O2ת��ΪAg������Znת��ΪZn(OH)2����������ӦʽΪ ������������Һ��pH ___ ������������䡱��С������
��4����ⷨ������ʱ������Ӧ��ֱ����Դ�� ������������AgNO3��HNO3�����Һ���������Һʱ��������������������ɫ���壬�����������ĵ缫��ӦʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
���仯��������Ȼ���й㷺���ڣ��������
ԭ���ش��������⣺
��1����ͼ��ʾһ���¶��£������Ϊ10L���ܱ������г���1molO2��һ������SO2��SO2��SO3(g)��Ũ����ʱ��仯�������
�ٸ��¶��£��ӷ�Ӧ��ʼ��ƽ��ʱ������ƽ����Ӧ������ ��
�ڸ��¶��£���Ӧ2SO2(g)+O2(g)  2SO3(g)��ƽ�ⳣ��Ϊ ��
2SO3(g)��ƽ�ⳣ��Ϊ ��
��2���Ի�ͭ����Ҫ�ɷ�CuFeS2��Ϊԭ�ϣ������ա�������ʹ��Ԫ�ؼ������й����ʽ���¯������ͭԪ�ػ�ԭΪͭ����������Ҫ��ӦΪ��
2Cu2S(s)+3O2(g) = 2Cu2O(s)+2SO2(g) ��H ="-768.2" kJ��mol��1
2Cu2O(s)+ Cu2S (s) = 6Cu(s)+SO2(g) ��H ="+116.0" kJ��mol��1
�١����ա�ʱ��ͨ����������ʹ��ͭ���������ɱ�ɰ����Ҫ�ɷ���Cu2S��FeS�������ʵ�����Ϊ1:2����SO2���÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
���������У�Cu2S������ʵ�����O2��Ӧ����Cu���Ȼ�ѧ����ʽΪ�� ��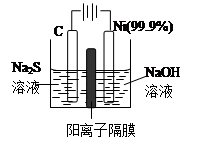
��3���õ��ķ�����������Һ����Ϊ��������о�������Ҫ��ʵ�����壬������ת��Ϊ�������ǵ�ⷨ�������������һ����Ҫ���ݡ�
��ͼ���ǵ������������ʵ��װ�ã�
����֪�����ķ�ӦΪ��(x+1)S2��=SxS2��+2xe�����������ĵ缫��Ӧʽ�ǣ� ��
����Ӧת��xmol����ʱ���������������Ϊ ����״���£���
�ڽ�Na2S��9H2O����ˮ������������Һʱ��ͨ�����ڵ����������ܽ⡣��ԭ���ǣ������ӷ�Ӧ����ʽ��ʾ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
������������Ȼ����Ϊԭ�Ϻϳɼ״������ⱻһһ���ˣ�����شٽ��˼״���ѧ�ķ�չ��
��1����̿��ˮ�����ķ�Ӧ���ƣ�����Ȼ��Ϊԭ��Ҳ�����Ƶ�CO��H2���÷�Ӧ�Ļ�ѧ����ʽΪ_________��
��2���ϳɼ״���һ�ַ�������CO��H2Ϊԭ�ϣ��������仯��ͼ��ʾ��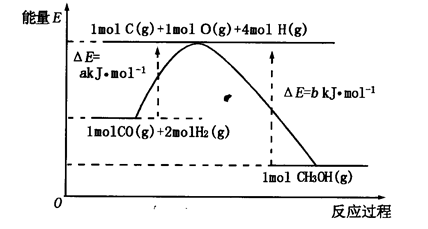
��ͼ��֪���ϳɼ״����Ȼ�ѧ����ʽΪ________________________________________��
��3����CO2Ϊԭ��Ҳ���Ժϳɼ״����䷴Ӧԭ��Ϊ��CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
����lL���ܱ������У�����1molCO2��3molH2����500���·�����Ӧ�����CO2(g)��CH3OH(g)��Ũ����ʱ�ʱ仯��ͼ��ʾ��
������˵����ȷ����_________________(����ĸ)��
| A��3minʱ��Ӧ�ﵽƽ�� |
| B��0��10minʱ��H2��ʾ�ķ�Ӧ����Ϊ0��225mol��-1��min-1 |
| C��CO2��ƽ��ת����Ϊ25�� |
D�����¶�ʱ��ѧƽ�ⳣ��Ϊ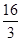 ��mol/L����2 ��mol/L����2 |
| ���� | ����1 | ����2 | ����3 |
| ��Ӧ��Ͷ������ʼ̬�� | 1molCO2��3molH2 | 0.5molCO2��1.5molH2 | 1molCH3OH��1molH2O |
| CH3OH��ƽ��Ũ��/mol?L-1 | c1 | c2 | c3 |
| ƽ��ʱ��ϵѹǿ/Pa | p1 | p2 | p3 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
Ŀǰ��ҵ�ϳɰ���ԭ���ǣ�N2(g)+3H2(g) 2NH3(g) ��H=��93.0kJ /mol�����ݱ�����һ�������£�2N2(g)+6H2O(l)
2NH3(g) ��H=��93.0kJ /mol�����ݱ�����һ�������£�2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ��H=" +1530.0kJ" /mol��
4NH3(g)+3O2(g) ��H=" +1530.0kJ" /mol��
��1��������ȼ���ȡ�H=_______________kJ/mol��
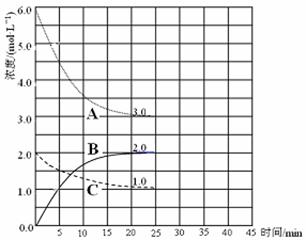
��2���ں��º�ѹװ���н��й�ҵ�ϳɰ���Ӧ������˵����ȷ���� ��
| A������������ٱ仯������ƽ�� |
| B�������ܶȲ��ٱ仯����δƽ�� |
| C��ƽ�����װ����ͨ��һ����Ar��ѹǿ���䣬ƽ�ⲻ�ƶ� |
| D��ƽ���ѹ��װ�ã����ɸ���NH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ij�¶��£���2L������3�����ʼ���з�Ӧ�� X��Y��Z�����ʵ�����ʱ��ı仯������ͼ����������������� 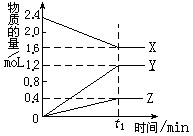
A���÷�Ӧ�Ļ�ѧ����ʽ��2X 3Y+Z 3Y+Z |
| B����t1minʱ���÷�Ӧ�ﵽ��ƽ��״̬ |
| C��t1minʱ��X��Y��Z�ķ�Ӧ������� |
| D�����÷�Ӧ�Ѵﵽƽ��״̬ʱ��ÿ����1molZ��ͬʱ����2molX |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com