
ú�������Ǹ�Ч����������ú̿����Ҫ;��֮һ��
(1)��250C 101kPaʱ��H2��O2��������1mol H2O(g)�ų�241.8kJ�����������Ȼ�ѧ����ʽΪ
___________
��֪: ��C(s)��O2(g)�TCO2(g) ��H����393.5kJ/mol
��CO(g)��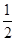 O2(g)�TCO2(g) ��H����283.0kJ/mol
O2(g)�TCO2(g) ��H����283.0kJ/mol
��̿��ˮ������Ӧ�ǽ�����ú��Ϊ����ȼ�ϵķ�����C(s)��H2O(g)�TCO(g)��H2(g) ��H=____kJ/mol
(2) CO������H2O(g)��һ��������Ӧ: CO(g)��H2O(g) CO2(g)��H2(g) ��H��0�ں����ܱ������У���ʼʱn(H2O)=0.20mol��n(CO)��0.10 mol,��8000Cʱ�ﵽƽ��״̬��K��1.0����ƽ��ʱ��������CO��ת������_____________(����������һλС��)��
CO2(g)��H2(g) ��H��0�ں����ܱ������У���ʼʱn(H2O)=0.20mol��n(CO)��0.10 mol,��8000Cʱ�ﵽƽ��״̬��K��1.0����ƽ��ʱ��������CO��ת������_____________(����������һλС��)��
(3) ��ҵ�ϴ�ú������Ļ�����з����H2�����а��ĺϳɣ���֪��Ӧ��ӦN2(g)��3H2(g 2NH3(g)����H��0���ڵ��������½��У��ı�������Ӧ��������I��II��III����ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��
2NH3(g)����H��0���ڵ��������½��У��ı�������Ӧ��������I��II��III����ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��
��N2��ƽ����Ӧ����v1(N2)��vII(N2)��vIII(N2)�Ӵ�С���д���Ϊ________��
���ɵ�һ��ƽ��ڶ���ƽ�⣬ƽ���ƶ��ķ��� ��________����ȡ�Ĵ�ʩ��________��
�۱Ƚϵ�II�η�Ӧ�¶�(T2)�͵�III�η�Ӧ�ٶȣ�T3)�ĸߵͣ�T2________T3�����=��<���жϵ�������________________��
��14�֣���1��H2(g)+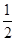 O2(g)�TlH2O(g) ��H����241.8kJ/mol ��2�֣�����131.3kJ ��1�֣�
O2(g)�TlH2O(g) ��H����241.8kJ/mol ��2�֣�����131.3kJ ��1�֣�
��2��66.7% ��2�֣� ��3����v1(N2)��vII(N2)��vIII(N2)��3�֣�
��������Ӧ���� �ӷ�Ӧ��ϵ���Ƴ�����NH3��3�֣�
�ۣ� �˷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ� ��3�֣�
���������������1����25�桢101kPaʱ��H2��O2��������1molH2O(g)�ų�241.8kJ���������������Ȼ�ѧ����ʽΪH2(g)+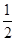 O2(g)�TlH2O(g) ��H����241.8kJ/mol��
O2(g)�TlH2O(g) ��H����241.8kJ/mol��
��֪��C(s)��O2(g)�TCO2(g) ��H����393.5kJ/mol
��CO(g)��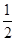 O2(g)�TCO2(g) ��H����283.0kJ/mol
O2(g)�TCO2(g) ��H����283.0kJ/mol
��H2(g)+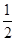 O2(g)�TlH2O(g) ��H����241.8kJ/mol
O2(g)�TlH2O(g) ��H����241.8kJ/mol
���Ը��ݸ�˹���ɣ��٣��ۣ��ڼ��õ�C(s)��H2O(g)�TCO(g)��H2(g)����Ӧ�ȡ�H����393.5kJ/mol��241.8kJ/mol��283.0kJ/mol����131.3kJ/mol��
��2�� CO(g)��H2O(g) CO2(g)��H2(g)
CO2(g)��H2(g)
��ʼ����mol�� 0.1 0.2 0 0
ת������mol�� x x x x
ƽ������mol�� 0.1��x 0.2��x x x
���ڷ�Ӧǰ�������������䣬���������ʵ�������Ũ�ȼ���ƽ�ⳣ��
�� ��1.0
��1.0
���x��
����ƽ��ʱ��������CO��ת������ ��100%��66.7%
��100%��66.7%
��3���ٸ���ͼ���֪�����߱�ʾ������Ũ�ȱ仯����v1(N2)����2mol/L��1mol/L����20min��0.05mol/��L?min����vII(N2)����1mol/L��0.62mol/L����15min��0.0253mol/��L?min����vIII(N2)����0.62mol/L��0.5mol/L����10min��0.012mol/��L?min������N2��ƽ����Ӧ����v1(N2)��vII(N2)��vIII(N2).
�ڸ���ͼ���֪���ڢ�ΰ����Ǵ�0��ʼ�ģ�˲�䷴Ӧ�ﵪ��������Ũ�Ȳ��䣬��˿���ȷ����һ��ƽ������ϵ���Ƴ��˰�����������������Ũ�ȣ�ƽ�������ƶ���
�۵ڢ�εĿ�ʼ��ڢ�ε�ƽ������ʵ�������ȣ����ݰ����������������٣������������ӿ��ж�ƽ���������ƶ��ġ�����ƽ�ʼʱŨ��ȷ����ƽ���ƶ�����������Ũ�ȵı仯����ģ�������Ŀ��������������������䣬��ı�ѹǿҲ�����ܣ����һ��Ϊ�¶ȵ�Ӱ�졣�˷�Ӧ����Ϊ���ȷ�Ӧ�������Ʋ�Ϊ�����¶ȣ���˴ﵽƽ����¶�һ���ȵڢ��ƽ��ʱ���¶ȵͣ���T2��T3��
���㣺�����Ȼ�ѧ����ʽ����д����˹���ɵ�Ӧ�ã���Ӧ���ʺ�ƽ�ⳣ���ļ����Լ���������Է�Ӧ���ʺ�ƽ��״̬��Ӱ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪H2��g����CO��g����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ��mol-1��-283.0kJ��mol��
��һ����̼��Һ̬ˮ��Ӧ�����ɶ�����̼���������Ȼ�ѧ����ʽΪ
________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������;�㷺����Ҫ��������Ӳ�ʻ����µĺϽ��Լ����ݵĵ�˿�������£����ܱ���������H2��ԭWO3�ɵõ������٣����ܷ�ӦΪ��
WO3 (s) + 3H2 (g) W (s) + 3H2O (g)
W (s) + 3H2O (g)
��ش��������⣺
��������Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ___________________________��
��ij�¶��·�Ӧ��ƽ��ʱ��H2��ˮ�����������Ϊ2:3����H2��ƽ��ת����Ϊ_____________________�����¶ȵ����ߣ�H2��ˮ����������ȼ�С����÷�ӦΪ��Ӧ_____________________������ȡ����ȡ�����
�������ܷ�Ӧ���̴��·�Ϊ�����Σ�������Ҫ�ɷ����¶ȵĹ�ϵ���±���ʾ��
| �¶� | 25�� ~ 550�� ~ 600�� ~ 700�� |
| ��Ҫ�ɷ� | WO3 W2O5 WO2 W |
 W (s) + 2H2O (g)����H �� +66.0 kJ��mol��1
W (s) + 2H2O (g)����H �� +66.0 kJ��mol��1  W (s) + 2H2O (g)����H �� ��137.9 kJ��mol��1
W (s) + 2H2O (g)����H �� ��137.9 kJ��mol��1  WO2 (g) �Ħ�H �� ______________________��
WO2 (g) �Ħ�H �� ______________________��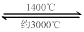 WI4 (g)������˵����ȷ����____________��
WI4 (g)������˵����ȷ����____________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����(H2NCONH2)��һ�ַdz���Ҫ�ĸߵ����ʣ��ڹ�ũҵ���������ŷdz���Ҫ�ĵ�λ��
��1����ҵ�Ϻϳ����صķ�Ӧ���£�
2NH3(l)+CO2(g) H2O(l)+H2NCONH2(l) ��H=-103��7 kJ��mol-1
H2O(l)+H2NCONH2(l) ��H=-103��7 kJ��mol-1
���д�ʩ��������������ص��������ʵ���
| A�����ø��� |
| B�����ø�ѹ |
| C��Ѱ�Ҹ���Ч�Ĵ��� |
| D����С��ϵ��CO2Ũ�� |
 H2NCOONH4(���������)(l) ��H1
H2NCOONH4(���������)(l) ��H1 H2O(l)+H2NCONH2(l) ��H2��
H2O(l)+H2NCONH2(l) ��H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����������(N2H4)Ϊȼ�ϣ������������������������߷�Ӧ���ɵ�������̬ˮ��
��֪��N2(g)��2O2(g)��N2O4(g) ��H��+10.7kJ��mol-1
N2H4(g)��O2(g)��N2(g)��2H2O(g) ��H��-543kJ��mol-1
д����̬�º�N2O4��Ӧ���Ȼ�ѧ����ʽ�� ��
����֪�����������ڴ����л��ڽϸ��¶��º����ȶ����ڣ��������ת��Ϊ�������������ƶ��ɶ���������ȡ�����������ķ�Ӧ����(���ʩ)�� ��
��2����ѧ�������һ��ʹ�ù������ʵ�ȼ�ϵ�أ���Ч�ʸ��ߣ������ں��캽�ա�
ͼ����ʾװ���У���ϡ����������Ϊ���Ե缫���������Ϸֱ�ͨ��CH4�Ϳ��������й��������Dz�����Y2O3��ZrO2���壬���ڸ������ܴ����������ɵ�O2-(O2+4e ��2O2-)
��c�缫Ϊ ��d�缫�ϵĵ缫��ӦʽΪ ��
��ͼ���ǵ��100mL 0.5mol��L-1 CuSO4��Һ��a�缫�ϵĵ缫��ӦʽΪ ����a�缫����56mL(��״��)���壬��������Һ��pH= (��������Һ����仯)����Ҫʹ�������Һ�ָ������ǰ��״̬���ɼ��� (ѡ����ĸ���)
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����P��s����Cl2������Ӧ����PCl3��PCl5����Ӧ���̺�������ϵ��ͼ��ʾ��ͼ�еġ�H��ʾ����1mol��������ݣ�
��ͼ�ش���������
��1��P��Cl2��Ӧ����PCl3���Ȼ�ѧ����ʽ ��
��2��PCl5�ֽ�����PCl3��Cl2���Ȼ�ѧ����ʽ ��
�����ֽⷴ��һ�����淴Ӧ���¶�T1ʱ�����ܱ������м���0.8mol PCl5����Ӧ�ﵽƽ��ʱ��ʣ��0.6mol PCl5����ֽ��ʦ�1���� ������Ӧ�¶���T1���ߵ�T2��ƽ��ʱPCl5�ֽ��ʦ�2����2 ��1������ڡ�����С�ڡ����ڡ�����
��3����ҵ���Ʊ�PCl5ͨ�����������У��Ƚ�P��Cl2��Ӧ�����м����PCl3��Ȼ���£��ٺ�Cl2��Ӧ����PCl5��ԭ���� ��
��4��P��Cl2��������Ӧ����1mol PCl5�ġ�H3= ��P��Cl2һ����Ӧ����1mol PCl5�ġ�H4 ��H3 ������ڡ�����С�ڡ����ڡ�����ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������Ȼ�ѧ����ʽ����ѧ����ʽ���缫��Ӧʽ������ʽ�ȣ�����д��
��1����֪��2Cu(s)��1/2O2(g)=Cu2O(s)����H = -169kJ��mol-1��
C(s)��1/2O2(g)=CO(g)����H = -110.5kJ��mol-1��
Cu(s)��1/2O2(g)=CuO(s)����H = -157kJ��mol-1
��̿���ڸ��������»�ԭCuO����Cu2O���Ȼ�ѧ����ʽ�ǣ�
��2����һ�������£���������������������·�Ӧ��2SO2(g)+O2(g) 2SO3(g)��д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��
2SO3(g)��д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��
��3���Լ��顢����Ϊ��Ӧ�KOH��Һ���������Һ����ȼ�ϵ�أ�����ӦʽΪ�� ��
��4����ˮAlCl3ƿ�Ǵ��а������䷴Ӧ�Ļ�ѧ����ʽΪ ��
��5����þ���������Ρ�ȼ�ϵ�أ���װ��ʾ��ͼ��ͼ���õ�ط�Ӧ���ܷ�Ӧ����ʽΪ_____________________��
��6����ҵ�ϵ�ⱥ��ʳ��ˮ�����ӷ���ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���÷�Ӧԭ���о��������ȡ��⼰�仯����ķ�Ӧ����Ҫ���塣
��1���ڷ�Ӧ��2SO2(g)+O2(g) 2SO3(g)�Ļ����ϵ�У�SO3�İٷֺ������¶ȵĹ�ϵ����ͼ(�������κ�һ�㶼��ʾƽ��״̬����
2SO3(g)�Ļ����ϵ�У�SO3�İٷֺ������¶ȵĹ�ϵ����ͼ(�������κ�һ�㶼��ʾƽ��״̬����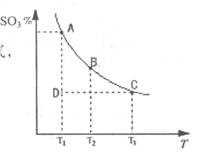
��2SO2(g)+O2(g) 2SO3(g)�ġ�H 0���>����<���������ں��¡���ѹʱ�����ƽ����ϵ��ͨ�뺤��ƽ�⽫ �ƶ�������������ҡ���������
2SO3(g)�ġ�H 0���>����<���������ں��¡���ѹʱ�����ƽ����ϵ��ͨ�뺤��ƽ�⽫ �ƶ�������������ҡ���������
�ڵ��¶�ΪT1����Ӧ���е�״̬Dʱ��V�� V�����>������<����=������
��2������ͼ��һ�������£�N2��H2�������淴Ӧ����1mol NH3�������仯ͼ���÷�Ӧ���Ȼ�ѧ��Ӧ����ʽ ��(��H�ú�Q1��Q2�Ĵ���ʽ��ʾ��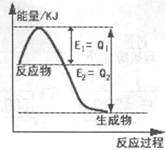
��25��Cʱ����a mol ? L�D1�İ�ˮ��b mol ? L�D1������������ϣ�������Һ��pH=7����c (NH4+) c(Cl�D)��a b���>������<����=������
��3����ˮ�к��д����Ի���̬��ʽ���ڵ��ȡ���Ԫ�ء���֪��250Cʱ��Ksp(AgCl)=1.6��10�D10mol2?L�D2��Ksp(AgI)=1.5��10�D16mol2?L�D2��
�� 250Cʱ���� 10mL0.002mol?L�D1�� NaCl��Һ�е��� 10mL0.002mol?L�D1AgNO3��Һ���а�ɫ�������ɣ���������Һ�м�������0.1mol ?L�D1��NaI��Һ����ɫ������ת��Ϊ��ɫ��������ԭ���� ���÷�Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��14�֣���������Ȼ���еIJ���ѭ����ϵ���¡�
��1��H2S�ڿ����п���ȼ�ա�
��֪�� 2H2S(g) + O2(g)  2S(s) + 2H2O(g) ��H= ��442.38 kJ/mol ��
2S(s) + 2H2O(g) ��H= ��442.38 kJ/mol ��
S(s) + O2(g)  SO2(g) ��H=��297.04 kJ/mol ��
SO2(g) ��H=��297.04 kJ/mol ��
H2S(g)��O2(g)��Ӧ����SO2(g)��H2O(g)���Ȼ�ѧ����ʽ�� ��
��2��SO2�Ǵ�����Ⱦ���ˮ�������õ�����SO2����������������¡�
�� SO2���ں�ˮ����H2SO3��H2SO3���ջ�����SO32��������뷽��ʽ�� ��
�� SO32�����Ա���ˮ�е��ܽ�������ΪSO42������ˮ��pH�� ������ߡ� �������䡱���͡�����
�� Ϊ������ˮ��pH���ɼ������ʵĺ�ˮ��ʹ���е�HCO3�����뷴Ӧ���䷴Ӧ�����ӷ���ʽ�� ��
�� ��������Ӧ��ͬʱ��Ҫ���������������ԭ���� ��
��3����Ȼ��ر���ԭ��ͭ�����ᆳ�������������ú���CuSO4��Һ���������������������ܵ�ZnS������ת��Ϊͭ����CuS�����û�ѧ�����ʾ��ZnSת��ΪCuS�Ĺ��̣� ��
��4��SO2��O2��H2SO4��Һ�п��Թ���ԭ��أ��为����Ӧʽ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com