
��1����������(N2H4)Ϊȼ�ϣ������������������������߷�Ӧ���ɵ�������̬ˮ��
��֪��N2(g)��2O2(g)��N2O4(g) ��H��+10.7kJ��mol-1
N2H4(g)��O2(g)��N2(g)��2H2O(g) ��H��-543kJ��mol-1
д����̬�º�N2O4��Ӧ���Ȼ�ѧ����ʽ�� ��
����֪�����������ڴ����л��ڽϸ��¶��º����ȶ����ڣ��������ת��Ϊ�������������ƶ��ɶ���������ȡ�����������ķ�Ӧ����(���ʩ)�� ��
��2����ѧ�������һ��ʹ�ù������ʵ�ȼ�ϵ�أ���Ч�ʸ��ߣ������ں��캽�ա�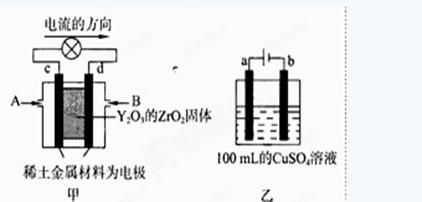
ͼ����ʾװ���У���ϡ����������Ϊ���Ե缫���������Ϸֱ�ͨ��CH4�Ϳ��������й��������Dz�����Y2O3��ZrO2���壬���ڸ������ܴ����������ɵ�O2-(O2+4e ��2O2-)
��c�缫Ϊ ��d�缫�ϵĵ缫��ӦʽΪ ��
��ͼ���ǵ��100mL 0.5mol��L-1 CuSO4��Һ��a�缫�ϵĵ缫��ӦʽΪ ����a�缫����56mL(��״��)���壬��������Һ��pH= (��������Һ����仯)����Ҫʹ�������Һ�ָ������ǰ��״̬���ɼ��� (ѡ����ĸ���)
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
��14�֣�
��1����2 N2H4(g) + N2O4(g)= 3N��(g)��4H20(g) ��H����1096.7KJ��mol-1��2�֣�
�ڼ�ѹ�����£���1�֣�
��2����������2�֣� CH4 - 8e- + 402-=CO2+2H2O ��2�֣�
��4OH��- 4e-=2H2O+O2 ��2�֣� 1 ��2�֣� a��c ��2�֣�
���������������1����a��N2��g��+2O2��g��=N2O4��g����H=10.7kJ��mol��1��b��N2H4��g��+O2��g��=N2��g��+2H2O��g����H=-543kJ��mol��1
���ݸ�˹����b��2-a�õ� 2N2H4��g��+N2O4��g��=3N2��g��+4H2O��g����H=-1096.7KJ��mol��1��
����2N2H4��g��+N2O4��g��=3N2��g��+4H2O��g����H=-1096.7KJ��mol��1��
�������������ڴ����л��ڽϸ��¶��º����ȶ����ڣ���������ת��Ϊ�����������ɶ���������ȡ������������2NO2 N2O4����Ӧ�Ƿ��ȷ�Ӧ����Ӧǰ�����������С���Է�Ӧ����Ϊ������ѹǿ�����¶������ڷ�Ӧ������У�
N2O4����Ӧ�Ƿ��ȷ�Ӧ����Ӧǰ�����������С���Է�Ӧ����Ϊ������ѹǿ�����¶������ڷ�Ӧ������У�
�ʴ�Ϊ������ѹǿ�����£�
��2����ͼ1��ԭ��أ����ݵ��������Ǵ�����������c�缫Ϊ�����������õ����ӷ�����ԭ��Ӧ��d�缫Ϊ��ظ��������ǵ��ӷ�����ԭ��Ӧ���������Ϸֱ�ͨ��CH4�Ϳ��������й��������Dz�����Y2O3��ZrO2���壬���ڸ������ܴ����������ɵ�O2�����ӣ���ϵ����غ�д���缫��ӦΪ��CH4- 8e-+4O2��=CO2+2H2O��
���������� CH4- 8e-+4O2��=CO2+2H2O��
����ͼ2��ʾ���100mL0.5mol?L-1CuSO4��Һ�������ĵ��ط�ӦΪ��2CuSO4+2H2O 2Cu+O2��+2H2SO4�����Դ����������Ϊ��������Һ�� �����������ǵ��ӷ���������Ӧ���缫��ӦΪ��4OH��-4e��=2H2O+O2������a�缫����56mL����״��������Ϊ���������ʵ���Ϊ0.0025mol�������������������ʵ���Ϊ0.01mol����Һ���������������ʵ���Ϊ0.01mol��c��H����=
2Cu+O2��+2H2SO4�����Դ����������Ϊ��������Һ�� �����������ǵ��ӷ���������Ӧ���缫��ӦΪ��4OH��-4e��=2H2O+O2������a�缫����56mL����״��������Ϊ���������ʵ���Ϊ0.0025mol�������������������ʵ���Ϊ0.01mol����Һ���������������ʵ���Ϊ0.01mol��c��H����=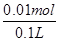 =0.1mol��L��1��PH=-lg0.1=1����������Һ��������CuSO4��Һÿ��ʧ2��Cuԭ�ӣ�����ʧ2�� Oԭ�ӣ��൱����ʧһ��CuO��Ϊ��ʹCuSO4��Һ���ָ�ԭŨ�ȣ�Ӧ����CuO��Ҳ���Լ���CuCO3�����ϻָ���ҺŨ�ȵĶ�����ϵ�������ܼ���Cu��OH��2��Cu2��OH��2CO3����ΪCuCO3+H2SO4
=0.1mol��L��1��PH=-lg0.1=1����������Һ��������CuSO4��Һÿ��ʧ2��Cuԭ�ӣ�����ʧ2�� Oԭ�ӣ��൱����ʧһ��CuO��Ϊ��ʹCuSO4��Һ���ָ�ԭŨ�ȣ�Ӧ����CuO��Ҳ���Լ���CuCO3�����ϻָ���ҺŨ�ȵĶ�����ϵ�������ܼ���Cu��OH��2��Cu2��OH��2CO3����ΪCuCO3+H2SO4 CuSO4+CO2��+H2O���൱�ڼ�CuO����Cu��OH��2+H2SO4
CuSO4+CO2��+H2O���൱�ڼ�CuO����Cu��OH��2+H2SO4 CuSO4+2H2O��Cu2��OH��2CO3+2H2SO4=2CuSO4 +CO2��+3H2O�������������������ˮ��ѡac��
CuSO4+2H2O��Cu2��OH��2CO3+2H2SO4=2CuSO4 +CO2��+3H2O�������������������ˮ��ѡac��
����4OH��- 4e-=2H2O+O2 ��1��ac��
���㣺�Ȼ�ѧ����ʽ����ѧ��Դ���͵��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1�� 8gҺ̬��CH3OH����������ȫȼ�գ����ɶ�����̼�����Һ̬ˮʱ�ͷų�Q kJ����������д��Һ̬CH3OHȼ���ȵ��Ȼ�ѧ����ʽ ��
��2���ڻ�ѧ��Ӧ�����У��ƻ��ɻ�ѧ����Ҫ�����������γ��»�ѧ���ֻ��ͷ�������
| ��ѧ�� | H��H | N��H | N��N |
| ����/kJ·mol��1 | 436 | 391 | 945 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)CH4(g )+2O2(g )=CO2(g )+2H2O(g ) ��H=-802.3kJ/mol
���Ȼ�ѧ��Ӧ����ʽ��������_____________________________________��
(2)��֪2g�Ҵ���ȫȼ������Һ̬ˮ�ų�Q kJ��������д����ʾ�Ҵ�ȼ���ȵ��Ȼ�ѧ��
��ʽ��____________________________________________________________.
(3)��֪��1mol H-H����1mol N-H����1mol 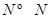 ���ֱ���Ҫ��������436kJ��391KJ��946kJ����N2��H2��Ӧ����1mol NH3(g)���Ȼ�ѧ����ʽ��___________________.
���ֱ���Ҫ��������436kJ��391KJ��946kJ����N2��H2��Ӧ����1mol NH3(g)���Ȼ�ѧ����ʽ��___________________.
(4)���ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ���ʱ�������㡣
��֪��C(ʯī��s)+O2(g)=CO2(g) ��H=-393.5kJ/mol ��
2H2(g)+O2(g)=2H2O(l) ��H=-571.6kJ/mol ��
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ��H=-2599kJ/mol ��
���ݸ�˹���ɣ�����298Kʱ��C��ʯī��s����H2(g)����1mol C2H2(g)��Ӧ���ʱ䣺
____________________________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(14��)2014��10�³����������������Ű�ӱ���������ȵ��������У�ȼú������β������ɿ�����Ⱦ��ԭ��֮һ��
��1������β����������Ҫԭ��Ϊ��2NO(g) + 2CO(g) 2CO2(g)+ N2(g)����H��0
2CO2(g)+ N2(g)����H��0
�ٸ÷�Ӧ��ƽ�ⳣ������ʽ ��
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬���� ������ţ���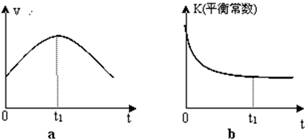
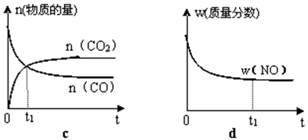
��2��ֱ���ŷ�úȼ�ղ������������������صĻ������⡣úȼ�ղ����������������������CH4����ԭNOx�������������������Ⱦ��
��֪��CH4(g)+2NO2(g)��N2(g)��CO2(g)+2H2O(g) ��H����867 kJ/mol
2NO2(g)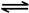 N2O4(g) ��H����56.9 kJ/mol
N2O4(g) ��H����56.9 kJ/mol
H2O(g) �� H2O(l) ��H �� ��44.0 kJ��mol
д��CH4����ԭN2O4(g)����N2��H2O(l)���Ȼ�ѧ����ʽ�� ��
��3����һ�������£�Ҳ������NH3����NOx����֪NO��NH3������Ӧ����N2��H2O������NO��NH3�Ļ����1mol����ַ�Ӧ��õ��Ļ�ԭ��������������1.4 g����ԭ��Ӧ�������NO�����ʵ���������_____________��
��4���Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ������2 molCH4������H2O��g����Ӧ��������_______mol H2��д���÷�Ӧ�Ļ�ѧ����ʽ_________________________________________________��
(5)���������Ƶõ�H2���Ժ�CO��һ�������ºϳɼ״��Ͷ����ѣ�CH3OCH3���������������ʡ������������ʵ���1:1����Ӧ����ԭ�������ʴ�100%���ϳɵ����ʿ����� ��
a.���� b.�״� c.��ȩ d.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ��������� �������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�ء���֪��H2(g)��CO(g)��CH3OH��1����ȼ���ȡ�H�ֱ�Ϊ-285.8 kJ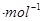 ��
�� ��һ283.0 kJ
��һ283.0 kJ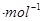 ��һ726.5��kJ
��һ726.5��kJ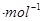 ����ش��������⣺
����ش��������⣺
��1����̫���ֽܷ�10mol H2O(1)���ĵ�������________kJ.
��2���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ��
__________________________________________________________________________.
��3�����ݻ�Ϊ2L���ܱ������У���CO2��H2�ϳɼ״����������������������£�
�����¶ȶԷ�Ӧ��Ӱ�죬ʵ��������ͼ��ʾ��ע��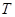 ��
�� ������300�棩��
������300�棩��
����˵����ȷ����_______________������ţ�
���¶�Ϊ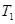 ʱ���ӷ�Ӧ��ʼ����Ӧ�ﵽƽ�⣬���ɼ״���ƽ������Ϊ��
ʱ���ӷ�Ӧ��ʼ����Ӧ�ﵽƽ�⣬���ɼ״���ƽ������Ϊ��
�ڸ÷�Ӧ��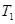 ʱ��ƽ�ⳣ����
ʱ��ƽ�ⳣ���� ʱ��С
ʱ��С
�۸÷�ӦΪ���ȷ�Ӧ
�ܴ���A��ķ�Ӧ��ϵ���¶ȴ�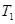 �䵽
�䵽 ���ﵽƽ��ʱ
���ﵽƽ��ʱ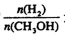 ����
����
��4����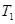 �¶�ʱ����1mol CO2��3mol H2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����CO2��ת����Ϊa�����ʱ�����ڵ�ѹǿ����ʼѹǿ֮��Ϊ___________��
�¶�ʱ����1mol CO2��3mol H2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����CO2��ת����Ϊa�����ʱ�����ڵ�ѹǿ����ʼѹǿ֮��Ϊ___________��
��5����ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ���У��������ҺΪ���ԣ������ķ�ӦʽΪ___________________;�����ķ�ӦʽΪ_____________________________________.����״̬�£���ȼ�ϵ������lmol�״����ܲ�����������Ϊ701.8kJ�����ȼ�ϵ�ص�����Ч��Ϊ_______________��ȼ�ϵ�ص�����Ч����ָ�������������������ȼ�ϵ�ط�Ӧ�����ͷŵ�ȫ������֮�ȣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ú�������Ǹ�Ч����������ú̿����Ҫ;��֮һ��
(1)��250C 101kPaʱ��H2��O2��������1mol H2O(g)�ų�241.8kJ�����������Ȼ�ѧ����ʽΪ
___________
��֪: ��C(s)��O2(g)�TCO2(g) ��H����393.5kJ/mol
��CO(g)��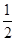 O2(g)�TCO2(g) ��H����283.0kJ/mol
O2(g)�TCO2(g) ��H����283.0kJ/mol
��̿��ˮ������Ӧ�ǽ�����ú��Ϊ����ȼ�ϵķ�����C(s)��H2O(g)�TCO(g)��H2(g) ��H=____kJ/mol
(2) CO������H2O(g)��һ��������Ӧ: CO(g)��H2O(g) CO2(g)��H2(g) ��H��0�ں����ܱ������У���ʼʱn(H2O)=0.20mol��n(CO)��0.10 mol,��8000Cʱ�ﵽƽ��״̬��K��1.0����ƽ��ʱ��������CO��ת������_____________(����������һλС��)��
CO2(g)��H2(g) ��H��0�ں����ܱ������У���ʼʱn(H2O)=0.20mol��n(CO)��0.10 mol,��8000Cʱ�ﵽƽ��״̬��K��1.0����ƽ��ʱ��������CO��ת������_____________(����������һλС��)��
(3) ��ҵ�ϴ�ú������Ļ�����з����H2�����а��ĺϳɣ���֪��Ӧ��ӦN2(g)��3H2(g 2NH3(g)����H��0���ڵ��������½��У��ı�������Ӧ��������I��II��III����ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��
2NH3(g)����H��0���ڵ��������½��У��ı�������Ӧ��������I��II��III����ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��
��N2��ƽ����Ӧ����v1(N2)��vII(N2)��vIII(N2)�Ӵ�С���д���Ϊ________��
���ɵ�һ��ƽ��ڶ���ƽ�⣬ƽ���ƶ��ķ��� ��________����ȡ�Ĵ�ʩ��________��
�۱Ƚϵ�II�η�Ӧ�¶�(T2)�͵�III�η�Ӧ�ٶȣ�T3)�ĸߵͣ�T2________T3�����=��<���жϵ�������________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�������������ʡ�����ȵ���Ҫԭ�ϣ�Χ�ƺϳɰ����ǽ�����һϵ�е��о�
��1�����������뵪������������������Ӧ�����Ƿ�Ӧ������ȴ����ͬ��
��֪��2H2 (g) + O2 (g) = 2H2O (g) ��H =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g) ��H =" -92.4" kJ/mol
2NH3 (g) ��H =" -92.4" kJ/mol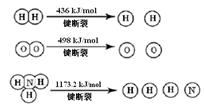
�������1 mol N��N����Ҫ���� kJ �� ���������л�ѧ�������������еĻ�ѧ���� ���ǿ�����������������������߷�Ӧ��������ͬ��
��2���̵��ǿ�ѧ�������о�����Ҫ���⡣��Ȼ���д�����Ȼ�Ĵ����̵����̣�N2 (g) + O2 (g) =" 2NO" (g) ��H =" +180.8" kJ/mol ����ҵ�ϳɰ������˹��̵���
�������̵ֹ���Ӧ��ƽ�ⳣ�������н�����ȷ���� ��
| ��Ӧ | �����̵� | ��ҵ�̵� | ||||
| �¶�/�� | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84��10-31 | 0.1 | 5��108 | 1.847 | 0.507 | 0.152 |
 2NH3 (g)��ü�������H2��ת����Ϊ40%��
2NH3 (g)��ü�������H2��ת����Ϊ40%��| | N2 | H2 | NH3 |
| �� | 1 | 3 | 0 |
| �� | 0.5 | 1.5 | 1 |
| �� | 0 | 0 | 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������ʹ�������Դ��չ����̼���á�������Ϊ��ѧ���о�����Ҫ���⡣�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�ء�
��1����֪���� 2CH3OH(1) + 3O2(g) = 2CO2(g) + 4H2O(g) ��H1 =" �C" 1275.6 kJ/mol
�� 2CO(g) + O2(g) = 2CO2(g) ��H2 =" �C" 566.0 kJ/mol
�� H2O(g) = H2O(1) ��H3 =" �C" 44.0 kJ/mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��___________��
��2�������״���ԭ��CO��H2��Դ�ڣ�CH4(g) + H2O(g)  CO(g) + 3H2(g) ��H>0
CO(g) + 3H2(g) ��H>0
��һ��������CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼa����Tl ________T2(�<������>������=������ͬ)��A��B��C���㴦��Ӧƽ�ⳣ����KA��KB��KC���Ĵ�С��ϵΪ___________��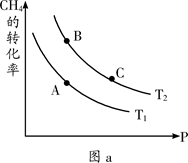
��100��ʱ����1 mol CH4��2 mol H2Oͨ���ݻ�Ϊ1 L�Ķ����ܷ������У�������Ӧ����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����__________
a�������������ܶȺ㶨
b����λʱ��������0.1 mol CH4ͬʱ����0.3 mol H2
c��������ѹǿ�㶨
d��3v��(CH4) = v��(H2)
����ﵽƽ��ʱCH4��ת����Ϊ0.5����100��ʱ�÷�Ӧ��ƽ�ⳣ��K =___________
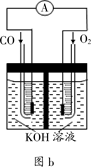
��3��ijʵ��С������CO(g) �� O2(g) ��KOH��aq����Ƴ���ͼb��ʾ�ĵ��װ�ã���õ�ظ����ĵ缫��ӦʽΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��14�֣��о������仯���������Ҫ���塣
��l����֪��
Ag2O��s��+2HC1��g�� 2AgC1��s��+H2O��1�� ��H1=��324��4 kJ��mo1��1
2Ag��s��+1/2O2��g�� Ag2O��s�� ��H2=��30��6 kJ��mo1��1
H2��g��+C12��g�� 2HC1��g�� ��H3=��184��4 kJ����mo1��1
2H2��9��+O2��g�� 2H2O��1�� ��H4=��571��2 l��mo1��1
д�������������ɹ����Ȼ������Ȼ�ѧ����ʽ________��
��2�����������γ���Fe(NO3)3��Һʴ�̣�д��Fe3+��Ag��Ӧ�����ӷ���ʽ___ _��Ҫ�ж�Fe(NO3)3��Һ��NO3���Ƿ�������ʴ���з�����Ӧ����ȡ ��������Һ��Ȼ��������Ƿ���Ag������Ӧ���ж���
��3����п���Ե�صĵ������ҺΪKOH��Һ���ŵ�ʱ������Ag2O2ת��ΪAg������Znת��ΪZn(OH)2����������ӦʽΪ ������������Һ��pH ___ ������������䡱��С������
��4����ⷨ������ʱ������Ӧ��ֱ����Դ�� ������������AgNO3��HNO3�����Һ���������Һʱ��������������������ɫ���壬�����������ĵ缫��ӦʽΪ____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com