
氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g) ΔH =" -92.4" kJ/mol
2NH3 (g) ΔH =" -92.4" kJ/mol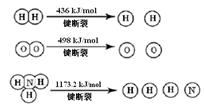
计算断裂1 mol N≡N键需要能量 kJ , 氮气分子中化学键比氧气分子中的化学键键 (填“强”或“弱”),因此氢气与二者反应的条件不同。
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:N2 (g) + O2 (g) =" 2NO" (g) ΔH =" +180.8" kJ/mol ,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是 。
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
 2NH3 (g)测得甲容器中H2的转化率为40%。
2NH3 (g)测得甲容器中H2的转化率为40%。| | N2 | H2 | NH3 |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
(9分)
(1)946 kJ/mol (2分) 强(1分)
(2)BC(2分,少选得1分,多选错选不得分)
(3)①逆向(1分) ② 丙>甲=乙(1分)
(4)4NH3(g) + 5NO(g) =" 4NO(g)" + 6H2O(g) ΔH=" -904.4kJ/mol" (2分) (化学反应书写正确得1分,ΔH正确得1分)
解析试题分析:
(1)断裂3 molH-H键需要能量436×3kJ与断裂1 mol N≡N键需要能量和减去形成2molNH3放出能量的差值为-92.4 kJ/mol ,可知断裂1 mol N≡N键需要能量946 kJ/mol;根据键能的大小可知氮气分子中化学键比氧气分子中的化学键键强。
(2)A.常温下,根据平衡常数大气固氮几乎不可能进行,而工业固氮虽然平衡常数大,不代表反应容易进行,错误;B.大气固氮反应程度很小,所以人类大规模模拟大气固氮是无意义的,正确;C.工业固氮温度越低,K越大,氮气与氢气反应越完全,正确;D.K越大说明合成氨反应程度很大,而不表示速率越大,错误。
(3)①根据转化率可知甲在建立平衡时各物质量分别为1.8,0.6,0.8,对比乙数据知乙中方向为逆向;② 甲乙为等效平衡,NH3的体积分数相同,丙的物料相当于甲乙的两倍,压强增大平衡正移,NH3的体积分数最大大,得:丙>甲=乙(1分)
(4)根据反应为:
①2H2 (g) + O2 (g) = 2H2O (g) ΔH =" -483.6" kJ/mol
②3H2 (g) + N2 (g)  2NH3 (g) ΔH =" -92.4" kJ/mol
2NH3 (g) ΔH =" -92.4" kJ/mol
③N2 (g) + O2 (g) =" 2NO" (g) ΔH =" +180.8" kJ/mol,
由①×3-②×2+③×2得4NH3(g) + 5NO(g) =" 4NO(g)" + 6H2O(g) ΔH=" -904.4kJ/mol"
考点:考查化学键、键能、化学平衡,盖斯定律等相关知识。


科目:高中化学 来源: 题型:填空题
(8分)把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g)=CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g)=CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g)=2CO2(g) △H3<0 ③
2H2(g)+O2 (g)=2H2O(g) △H4<0 ④
请回答下列问题:
(1)途径I放出的热量 ( 填“大于”“等于”或“小于”) 途径II放出的热量。
(2)△H1、△H2、△H3、△H4的数学关系式是 。
(3)12g炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为 。
(4)煤炭作为燃料采用途径II的优点有 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义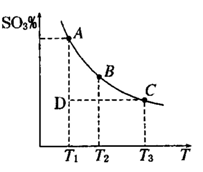
(1)硫酸生产中,SO2催化氧化生成SO3; 2SO2(g)+O2(g) 2SO3(g),混合体系中SO3 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
2SO3(g),混合体系中SO3 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
①2SO2(g)+O2(g) 2SO3(g)的△H 0
2SO3(g)的△H 0
(填“>”或“<”):若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不”)
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1 K2;反应进行到状态D时, 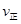
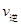 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农 业生产、生活中有着重要作用,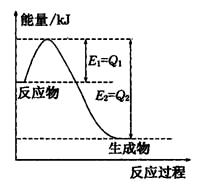
①如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式:
(△H的数值用含字母Q1、Q2的代数式表示)
②氨气溶于水得到氨水,在25℃下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出该混合溶液中氨水的电离平衡常数 .
(3)海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在,在25℃下,向0.1L0.002mol·L-l的NaCl溶液中逐滴加入适量的0.1L0.002mol·L-l硝酸银溶液,有白色沉淀生成,从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中继续加入0.1L0.002mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知:25℃时KSP(AgCl)=1.6×l0-10 KSP(AgI)=1.5×l0-16)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)、①用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)=N2O4(g) ΔH=+10.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543kJ·mol-1
写出气态肼和N2O4反应的热化学方程式: 。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,其很容易转化为二氧化氮。试推断由二氧化氮制取四氧化二氮的反应条件(或措施): 。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。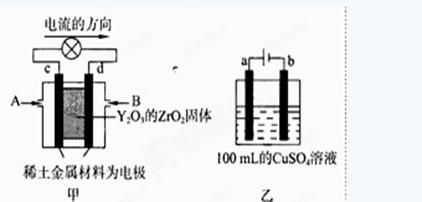
图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e →2O2-)
①c电极为 ,d电极上的电极反应式为 。
②图乙是电解100mL 0.5mol·L-1 CuSO4溶液,a电极上的电极反应式为 。若a电极产生56mL(标准状况)气体,则所得溶液的pH= (不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入 (选填字母序号)
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)医疗上常用浓度为75%的某有机物水溶液作皮肤消毒液。该有机物的结构简式是 。
(2)一定条件下,0.1mol氨气与氧气反应生成两种无毒气体,放出31.67kJ热量。写出核反应的热化学方程式: 。
(3)现有固体X,可能含有Cu、SiO2、KNO3、NH4Cl中的一种或几种。为了探究其成分,某学习小组取该样品进行如下实验(部分产物已略去)。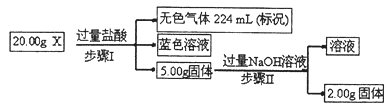
①步骤I中发生反应的离子方程式为 。
②20.00gX中Cu的质量分数为 。
③为进一步确定固体X的组成,常温下,学习小组另取固体X加水,充分搅拌后过滤,测得滤液的pH<7。他们判断一定有NH4Cl,理由是 。
(4)工业上常用电渗析法生产HI,其模拟实验如图。写出阴极的电极反应式: 。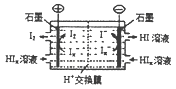
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ·mol-1,
C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1,
Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
用炭粉在高温条件下还原CuO生成Cu2O的热化学方程式是:
(2)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g),写出该反应的化学平衡常数表达式:
2SO3(g),写出该反应的化学平衡常数表达式:
(3)以甲烷、空气为反应物,KOH溶液作电解质溶液构成燃料电池,则负极反应式为: 。
(4)无水AlCl3瓶盖打开有白雾,其反应的化学方程式为 。
(5)“镁—次氯酸盐”燃料电池,其装置示意图如图,该电池反应的总反应方程式为_____________________。
(6)工业上电解饱和食盐水的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
(1)已知:C(石墨)+CO2(g) 2CO(g) △H=" +" 172.5 kJ·mol-1
2CO(g) △H=" +" 172.5 kJ·mol-1
则反应:Fe2O3(S) +3C(石墨) 2Fe(s)+3CO(g) △H= kJ·mol-1
2Fe(s)+3CO(g) △H= kJ·mol-1
(2)冶炼铁反应 Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H=-28.5 kJ·mol-1的平衡常数表达式K= ,温度降低后,K值 .(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) △H=-28.5 kJ·mol-1的平衡常数表达式K= ,温度降低后,K值 .(填“增大”、“不变”或“减小”)。
(3)在ToC时,该反应的平衡常数K=27,在1L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| | Fe2 O3 | CO | Fe | CO2 |
| 甲容器 | 1.0 mol | 1.0 mol | 1.0 mol | 1.0 mol |
| 乙容器 | 1.0 mol | 2.0 mol | 1.0 mol | 1.0 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成氨工业对国防具有重要意义,如制硝酸、合成纤维以及染料等
(1)已知某些化学键的键能数据如下表:
| 化学键 | N≡N | H—H | N—H |
| 键能kJ·mol-1 | 946 | 436 | 390 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
依据事实,写出下列反应的热化学方程式。
(1)1molC2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1411kJ热量。
(2)1molC2H5OH(l)与适量O2(g)反应生成CO2(g)和H2O(l),放出1366.8kJ热量。
(3)2molAl(s)与适量O2(g)反应生成Al2O3(s),放出1669.8kJ热量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com