
【题目】在25℃时,将1.0Lc mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
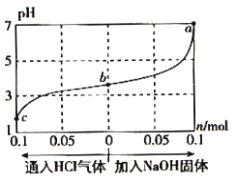
A.水的电离程度:a>b>c
B.b点对应的混合溶液中:c(Na+)<c(CH3COO-)
C.c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
D.该温度下,a、b、c三点CH3COOH的电离平衡常数均为![]()
【答案】D
【解析】
根据图示可知,原混合液显酸性,则为醋酸与醋酸钠的混合液,a点加入0.10molNaOH固体,pH=7,说明原溶液中CH3COOH的物质的量稍大于0.2mol。酸或碱抑制水的电离,含弱酸根离子的盐促进水的电离,酸或碱的浓度越大,抑制水电离程度越大。
A.1.0Lcmol·L-1 CH3COOH溶液与0.1molNaOH固体混合,发生的反应为:CH3COOH+NaOH=CH3COONa+H2O,反应后的溶液是CH3COOH和CH3COONa的混合溶液,其中CH3COONa的水解能够促进水的电离,而CH3COOH的电离会抑制水的电离。若向该混合溶液中通入HCl,b→c发生的反应为:CH3COONa+HCl=CH3COOH+NaCl,CH3COONa减少,CH3COOH增多,水的电离程度减小;若向该混合溶液中加入NaOH固体,b→a发生的反应是:CH3COOH+NaOH=CH3COONa+H2O,CH3COONa增多,CH3COOH减少,水的电离会逐渐增大,因此水的电离程度:a>b>c,故A正确;
B. b点对应的混合溶液呈酸性,c(H+)>c(OH-),则此时溶质为CH3COOH和CH3COONa,结合电荷守恒,所以c(Na+)<c(CH3COO-),故B正确;
C. c点对于的溶液是通入0.1molHCl的溶液,相当于HCl中和氢氧化钠,所以c点溶液相当于原CH3COOH溶液和0.1molNaCl固体的混合液,醋酸浓度大于0.2mol/L,所以c(CH3COOH)>c(Na+)>c(OH-),故C正确;
D.该温度下,CH3COOH的电离平衡常数![]() ,a点对于溶液中pH=7,c(Na+)=c(CH3COO-)=0.2mol/L,c(H+)=c(OH-)=10-7mol/L,则溶液中c(CH3COOH)=(c-0.2)mol/L,带入公式得
,a点对于溶液中pH=7,c(Na+)=c(CH3COO-)=0.2mol/L,c(H+)=c(OH-)=10-7mol/L,则溶液中c(CH3COOH)=(c-0.2)mol/L,带入公式得![]() ,故D错误。
,故D错误。


科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:
FeO(固)+CO(气)Fe(固)+CO2(气)ΔH>0
(1)则该反应中平衡常数表达式K=_________________
(2)已知1100℃时K=0.263。温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值_______平衡常数K值___(均填增大,减小或不变).
(3)1100℃时测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于平衡状态________(选填是或否),此时化学反应速率v正____v逆(选填>,<,=)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3与100ml稀盐酸反应生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
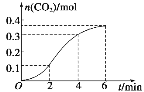
A.反应在2~4min内平均反应速率最大
B.反应在2~4min内用盐酸表示平均反应速率为v(HCl)=0.1mol·L-1·min-1
C.反应开始阶段反应速率逐渐上升是由于温度比浓度对反应速率的影响大
D.4min后,反应速率减小的主要原因是c(H+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室可用如下装置(略去部分夹持仪器)制取SO2并验证其性质。
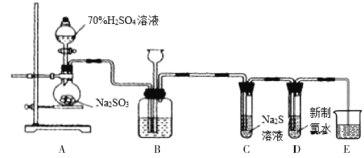
(1)盛装亚硫酸钠的仪器名称为________,若将亚硫酸钠改为铜片,与浓硫酸反应制取SO2,还缺少的仪器有_______,写出用铜片制取SO2的化学方程式_________________________。
(2)装置B的作用之一是通过观察产生气泡的多少判断SO2生成的快慢,其中的液体最好选择___________(填代号)。
a.饱和Na2CO3溶液 b.NaOH溶液 c.饱和NaHCO3溶液 d.饱和NaHSO3溶液
(3)验证SO2的还原性。取充分反应后装置D中的溶液,将其分成三份,分别进行如下实验:
方案I:第一份溶液中滴入AgNO3溶液,有白色沉淀生成;
方案II:第二份溶液中滴入品红溶液,红色褪去;
方案III:第三份溶液中滴入BaCl2溶液,产生白色沉淀。
上述方案合理的是___________(填“方案I”、“方案II”或“方案III”);对不合理的方案作出简要评价___________(如果认为都合理,可以不作答)。
II.已知2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,若采用该方案制备Cl2并验证Cl2的性质。B、C、D中的试剂依次为:饱和食盐水、FeCl2溶液、石蕊溶液。
(4)C中反应的离子方程式为:_________________________________。
(5)D中可能观察到的现象为:_________________________________。
(6)装置E中盛放NaOH溶液,其目的是_________________________________,该反应的化学方程式是:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在《科学》(Science)中的一篇论文中,圣安德鲁斯的化学家描绘出了一种使用DMSO(二甲亚砜)作为电解液,并用多孔的黄金作为电极的锂—空气电池的实验模型,这种实验电池在充放电100次以后,其电池容量仍能保持最初的95%。该电池放电时在多孔的黄金上氧分子与锂离子反应,形成过氧化锂,其装置图如图所示。下列有关叙述正确的是
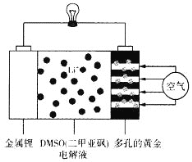
A.多孔的黄金作为正极,负极的电极反应式为Li-e-=Li+
B.DMSO电解液能传递Li+和电子,但不能换成水溶液
C.该电池放电时每消耗2mol空气,转移4mol电子
D.给该锂—空气电池充电时,金属锂接直流电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为 。下列关于苯佐卡因的叙述正确的是
。下列关于苯佐卡因的叙述正确的是
A. 分子式为C9H14NO2
B. 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种
C. 1mol该化合物最多与4mol氢气发生加成反应
D. 分子中将氨基转化成硝基的反应为氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液 A 逐渐加入固体 B 中,下列叙述中不正确的是( )
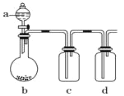
A.若 a 为浓盐酸,b 为 MnO2,c 中盛品红溶液,则 c 中溶液不褪色
B.若 a 为稀硫酸,b 为 FeS,c 中盛硫酸铜溶液,则 c 中产生淡黄色沉淀
C.若 a 为醋酸溶液,b 为贝壳,c 中盛过量澄清石灰水,则 c 中溶液变浑浊
D.若 a 为浓氨水,b 为生石灰,c 中盛 AlCl3 溶液,则 c 中产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
![]()
A.海水淡化的常用方法有蒸馏法、电渗析法和过滤法
B.pH相等的三种溶液:![]() 溶液
溶液![]() 溶液
溶液![]() 溶液,其浓度大小顺序为
溶液,其浓度大小顺序为![]()
C.在![]() 和
和![]() 的混合溶液中加入
的混合溶液中加入![]() 产生黑色沉淀,证明
产生黑色沉淀,证明![]()
D.侯式制碱法的化学方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列物质的结构简式:
(1)写出与环辛四烯![]() 互为同分异构体且属于芳香烃的分子的结构简式:___。
互为同分异构体且属于芳香烃的分子的结构简式:___。
(2)写出与苯互为同系物且一氯代物只有一种的物质的结构简式(仅写两种支链数不同且支链 数小于4的物质):___、___。
(3)某烷烃A蒸气的密度是相同状况下氢气密度的64倍,经测定得知A分子中共含有6个甲基。
①若A不可能是氢气与烯烃加成的产物,A的结构简式为___;
②若A是炔烃与氢气加成的产物,A的结构简式是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com