
【题目】高炉炼铁中发生的基本反应之一如下:
FeO(固)+CO(气)Fe(固)+CO2(气)ΔH>0
(1)则该反应中平衡常数表达式K=_________________
(2)已知1100℃时K=0.263。温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值_______平衡常数K值___(均填增大,减小或不变).
(3)1100℃时测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于平衡状态________(选填是或否),此时化学反应速率v正____v逆(选填>,<,=)。
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】在一体积为1 L的密闭容器中,通入一定量的CO和H2O,在850 ℃ 发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。CO和H2O浓度变化如图:
CO2(g)+H2(g) ΔH<0。CO和H2O浓度变化如图:

(1)0~4 min的平均反应速率v(CO)=__________________mol·(L·min)-1。
(2)850 ℃时,平衡常数K=___________________。
(3)850 ℃时,若向该容器中充入1.0 mol CO、3.0 mol H2O,则CO的平衡转化率为___________。
(4)能判断该反应达到化学平衡状态的依据是________(填选项序号)。
a.v正(H2)=v逆(H2O) b.c(CO2)=c(CO)
c.容器中气体密度不变 d.1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,0.200 molL-1的HA溶液与0.200 molL-1的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下表,下列说法正确的是
微粒 | X | Y | Na+ | A- |
浓度/(mol·L-1) | 8.00 | 2.50 | 0.100 | 9.92 |
A. 0.1mol·L-1HA溶液的pH=1 B. 该温度下Kw=1.0![]() 10-14
10-14
C. 微粒X表示OH-,Y表示H+ D. 混合溶液中:n(A-)+n(X)=n(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“异丙苯氧化法”生产丙酮和苯酚的合成路线如下,各反应的原子利用率均为100%。下列说法正确的是
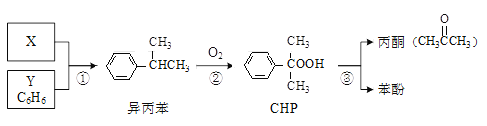
A. X的分子式为C3H8B. Y与异丙苯可用酸性KMnO4溶液鉴别
C. CHP与CH3COOH含有相同的官能团D. 可以用分液的方法分离苯酚和丙酮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与实验目的对应的是 ( )
实验操作 | 实验目的 |
A、向淀粉水解液中直接滴加碘水 | 检验淀粉是否完全水解 |
B、C2H4 与SO2 混合气体通过盛有酸性高锰酸钾的洗气瓶 | 除去 C2H4 中的SO2 |
C、 将电石和饱和氯化钠溶液反应生成的气体通入饱和硫酸铜溶液中 | 验证生成的是乙炔气体 |
D、将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验溴乙烷中的溴 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞液,在F极附近显红色.试回答以下问题:
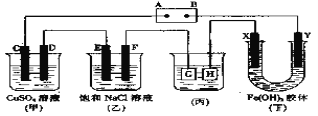
(1)电源A极的名称是_______。甲装置中电解反应的总化学方程式_____________________。
(2)如果收集乙装置中产生的气体,两种气体的体积比是______________。
(3)欲用丙装置给铜镀银,G应该是_______,电镀液的主要成分是_________(填化学式),G电极发生的反应是_____________________________。
(4)装置丁中的现象是__________________________,说明______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.NaNO3溶液中:c(Na+)=c(NO3-)
B.在Na2CO3溶液中,c(H+)=c(OH-)
C.在CH3COOH溶液中,c(CH3COOH)=c(H+)
D.K2S溶液中:2c(K+)=c(S2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以煤为主要原料可以制备乙二醇,相关工艺流程如下:

(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式_______
(2)合成气在不同催化剂作用下,可以合成不同的物质。下列物质仅用合成气为原料就能得到且原子利用率为100%的是_____填字母)。
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成份为CH4)与C02反应制备合成气。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
2H2(g)+ O2(g)= 2H2O(l) △H=-571.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
则CH4与CO2生成合成气的热化学方程式为____________________。
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:
CH3OOC—COOCH3(g)+ 4H2(g)![]() HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为提高乙二醇的产量和速率,宜采用的措施是___________(填字母)。
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:CH3OOC—COOCH3+ 2H2O![]() HOOC—COOH+2CH3OH
HOOC—COOH+2CH3OH
①草酸是二元弱酸,可以制备![]() (草酸氢钾),
(草酸氢钾),![]() 溶液呈酸性,用化学平衡原理解释:__________________。
溶液呈酸性,用化学平衡原理解释:__________________。
②在一定的![]() 溶液中滴加NaOH溶液至中性。下列关系一定不正确的是_______(填字母)。
溶液中滴加NaOH溶液至中性。下列关系一定不正确的是_______(填字母)。
A.![]()
B.![]()
C.![]()
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的_____填“正”或“负”)极,负极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0Lc mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
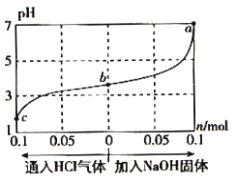
A.水的电离程度:a>b>c
B.b点对应的混合溶液中:c(Na+)<c(CH3COO-)
C.c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
D.该温度下,a、b、c三点CH3COOH的电离平衡常数均为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com