
【题目】普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。下列关于普伐他汀的性质描述正确的是( )
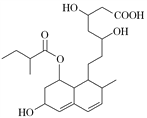
①能与FeCl3溶液发生显色反应 ②能使酸性KMnO4溶液褪色 ③能发生加成、取代、消去反应 ④1 mol 该物质最多可与1 mol NaOH 反应
A. ①②B. ②③C. ①④D. ②④
科目:高中化学 来源: 题型:
【题目】电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解,据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1, 该温度下,pH=10的Ba(OH)2溶液的物质的量浓度为_________ mol·L-1。
(2)25℃时,将 a mol·L-1 的醋酸和 b mol·L-1 的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=__________ mol·L-1,a_______ b(填“﹥”、“﹤”或“=”)。
(3)工业上采取用氨水除去SO2,已知25 ℃,NH3 H2O的Kb=1.8×10-5,H2SO3的 Ka1=1.3 × 10一2,Ka2=6.2 × 10一8。若氨水的浓度为2.0 mo1/ L,溶液中的c(OH-)=_____ mo1/ L;将SO2通入该氨水中,当c(OH-)降至2.0 × 10一6mo1/ L时,溶液中的![]() =_____________。
=_____________。
(4)将AgCl分别放入:①5 mL水 ②10 mL 0.1 mol·L-1 MgCl2溶液③40 mL 0.3mol·L-1 盐酸溶液中溶解至溶液饱和 ④20 mL 0.5mol·L-1 NaCl溶液 ,各溶液中Ag+的浓度分别为a、b、 c、d,它们由大到小的排列顺序是____________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器。研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是( )

A. 青铜器发生电化学腐蚀,图中c作负极
B. 潮湿环境中Cl-浓度大有利于多孔粉状锈的生成
C. 若生成0.2 mol Cu2(OH)3Cl,则消耗的O2体积为4.48L
D. 环境中的Cl与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH+Cl===Cu2 (OH)3Cl↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为短周期元素,它们在周期表中的位置如图。已知B、C两元素在周期表中族序数之和是A元素序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组是( )

A.Be、Na、AlB.B、Mg、SiC.O、P、ClD.C、Al、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将如图所示实验装置的K闭合,下列判断正确的是

A. b电极上发生还原反应 B. 片刻后甲池中c(Cl-)增大
C. 电子沿Zn→a→b→Cu路径流动 D. 片刻后可观察到滤纸b点变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中位置关系如图所示。
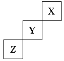
(1)X元素的单质分子式是___。若X核内中子数与质子数相等,X单质的摩尔质量是___。
(2)Y单质的电子式是___。
Y单质与水反应的化学方程式:___。
Z与钠形成的化合物的电子式是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究碳酸钙与盐酸反应的反应速率,某同学通过实验测定碳酸钙固体与足量稀盐酸反应生成CO2的体积随时间的变化情况,绘制出下图所示的曲线甲。下列有关说法中不正确的是

A. 在0-t1、t1-t2、t2-t3中,t1-t2生成的CO2气体最多
B. 因反应放热,导致0-t1内的反应速率逐渐增大
C. 若用单位时间内CO2的体积变化来表示该反应的速率,则t2-t3时间内平均反应速率为![]() mLs-1
mLs-1
D. 将碳酸钙固体研成粉末,则曲线甲将变成曲线乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为________。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为____________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为____________。
(4)相同条件下,体积比为a∶b和质量比为a∶b的H2和O2的混合气体,其平均摩尔质量分别是______________和______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备丙烯的方法有多种,具体如下(本题丙烯用C3H6表示):
(1)丙烷(C3H8)脱氢制备丙烯(C3H6)
由下图可得,C3H8(g)![]() C3H6(g)+H2(g),△H=_________kJ/.mol
C3H6(g)+H2(g),△H=_________kJ/.mol

(2)用惰性电极电解CO2的酸性溶液可得丙烯(C3H6),其原理如下图所示。则b的电极反应式为__________。

(3)以丁烯(C4H8)和乙烯(C2H4)为原料反应生成丙烯(C3H6)的方法被称为“烯歧化法”,反应为:C4H8(g)+C2H4(g)![]() 2C3H6(g) △H>0
2C3H6(g) △H>0
一定温度下,在一体积恒为VL的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化反应。
I.该反应达到平衡的标志是______________
a.反应速率满足:2v生成(C4H8)=v生成(C3H6)
b.C4H8、C2H4、C3H6的物质的量之比为1:1:2
c.混合气体的平均相对分子质量不再改变
d.C4H8、C2H4、C3H6的浓度均不再变化
Ⅱ.已知t1min时达到平衡状态,测得此时容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为![]() 。
。
①该时间段内的反应速率v(C4H8)= _______mol/(L·min)。(用只含m、V、t1的式子表示)。
②此反应的平衡常数K=______________。
③t1min时再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数_______![]() (填“>”“<”“=”)。
(填“>”“<”“=”)。
(4)“丁烯裂解法”是另一种生产丙烯的方法,但生产过程中伴有生成乙烯的副反应发生,具体反应如下:主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
①从产物的纯度考虑,丙烯和乙烯的质量比越高越好。则从下表现的趋势来看,下列反应条件最适宜的是__________(填字母序号)。
a.300℃0.1MPa b.700℃0.1MPa c.300℃0.5MPa d.700℃0.5MPa
②下图中,平衡体系中丙烯的百分含量随压强增大呈上升趋势,从平衡角度解释其可能的原因是_____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com