
【题目】(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为________。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为____________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为____________。
(4)相同条件下,体积比为a∶b和质量比为a∶b的H2和O2的混合气体,其平均摩尔质量分别是______________和______________。
【答案】64 30 g·mol-1 44 g·mol-1 (2a+32b)/(a+b)g·mol-1 (32a+32b)/(16a+b) g·mol-1
【解析】
试题(1)根据![]() 计算;(2)根据同温同压下,体积比等于物质的量比计算;(3)根据同温同体积的气体,压强比等于物质的量比计算;(4)根据同温同压下,体积比等于物质的量比分析;
计算;(2)根据同温同压下,体积比等于物质的量比计算;(3)根据同温同体积的气体,压强比等于物质的量比计算;(4)根据同温同压下,体积比等于物质的量比分析;
解析:(1)根据![]() ,
,![]() ,M=64g/mol;(2)同温同压下,体积比等于物质的量比,
,M=64g/mol;(2)同温同压下,体积比等于物质的量比,![]() ;M=30g/mol;(3)同温同体积的气体,压强比等于物质的量比,
;M=30g/mol;(3)同温同体积的气体,压强比等于物质的量比,![]() , M=44g/mol;(4)同温同压下,体积比等于物质的量比,体积比为a∶b的H2和O2的混合气体,即物质的量比为a:b的H2和O2的混合气体,总质量是(2a+32b)g、总物质的量是(a+b)mol,平均摩尔质量M=
, M=44g/mol;(4)同温同压下,体积比等于物质的量比,体积比为a∶b的H2和O2的混合气体,即物质的量比为a:b的H2和O2的混合气体,总质量是(2a+32b)g、总物质的量是(a+b)mol,平均摩尔质量M=![]() g·mol-1;质量比为a∶b的H2和O2的混合气体,总质量是(a+b)g、总物质的量是(
g·mol-1;质量比为a∶b的H2和O2的混合气体,总质量是(a+b)g、总物质的量是(![]() )mol,其平均摩尔质量是(32a+32b)/(16a+b) g·mol-1。
)mol,其平均摩尔质量是(32a+32b)/(16a+b) g·mol-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。下列关于普伐他汀的性质描述正确的是( )
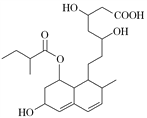
①能与FeCl3溶液发生显色反应 ②能使酸性KMnO4溶液褪色 ③能发生加成、取代、消去反应 ④1 mol 该物质最多可与1 mol NaOH 反应
A. ①②B. ②③C. ①④D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 0.1mol/L的FeCl3溶液与0.01mol/L的FeCl3溶液中,Fe3+的浓度之比大于10
B. 常温下,浓度均为0.1 mol·L-1的①醋酸、②盐酸、③醋酸钠溶液,水的电离程度的顺序为③>①>②
C. 将相同体积的pH=3的硫酸和pH=11的NaOH溶液混合,所得溶液一定为中性
D. 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是a>c>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. CH3-CH=CH-CH=CH2无顺反异构
C. 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D. 菲的结构简式为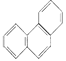 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)泡沫灭火器的灭火原理是(用离子方程式表示)_____________________。
(2)①已知T℃时,Kw=1×10-12,在该温度时,将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=____。
②某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- ![]() H++A2-,则NaHA溶液中,写出符合原子(物料)守恒的各粒子浓度关系的等式_____________
H++A2-,则NaHA溶液中,写出符合原子(物料)守恒的各粒子浓度关系的等式_____________
(3)pH=2的两种一元酸HA和HB,体积均为100 mL,稀释过程中pH与溶液体积的关系如图。
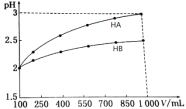
①则NaB水溶液是否呈中性?原因?______________(用离子方程式表示)。
②用NaOH溶液滴定HB溶液,指示剂宜选择_________,滴定终点现象为____________。
A.甲基橙 B.酚酞 C.石蕊
(4)NaHSO3溶液呈酸性,则溶液中,各离子浓度由大到小的顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1 mol/L H2R溶液中滴加0.1 mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。已知pKa=﹣lgKa,二元弱酸H2R的pKa1=1.89,pKa2=7.21。下列有关说法错误的是

A. 溶液的导电性:点a弱于点b
B. 离子浓度c(R2-):点c小于点d
C. H2R + R2-=2HR-平衡常数>105,反应趋于完全
D. 点b时,y<7且![]() <1
<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgSO4固体。
A. ①②③⑤ B. ③⑥ C. ③ D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是( )

A.该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B.0℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g) 2SO3(g) ΔH=-2akJ·mol-l
C.该反应中,反应物的总键能小于生成物的总键能
D.ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com