
【题目】下列有关同分异构体数目的叙述不正确的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. CH3-CH=CH-CH=CH2无顺反异构
C. 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D. 菲的结构简式为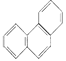 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
【答案】B
【解析】
A.含3个碳原子的烷基即丙基有2种:-CH2CH2CH3、-CH(CH3)2,甲苯苯环上有3种等效氢原子(邻、间、对),甲苯苯环上的一个氢原子被丙基取代所得产物种数=2×3=6,A项正确;
B. CH3-*CH=*CH-CH=CH2其中带*号的碳碳双键的碳原子上都连接2个不同的基团,存在顺反异构:![]() ,B项错误;
,B项错误;
C.含有5个碳原子的饱和链烃即为戊烷,戊烷有3种同分异构体:CH3(CH2)3CH3、(CH3)2CHCH2CH3、C(CH3)4,其中正戊烷CH3(CH2)3CH3的一氯代物有3种,C项正确;
D.菲分子为平面结构,有一条对称轴,所以菲分子中有5种等效氢原子: ,它与硝酸反应可生成5种一硝基取代物,D项正确;答案选B。
,它与硝酸反应可生成5种一硝基取代物,D项正确;答案选B。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)不能作为达到平衡状态的依据的是
2NH3(g)不能作为达到平衡状态的依据的是
A. N2,H2和NH3的质量分数不再改变
B. c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C. 断开1 mol H-H的同时形成1 mol H-H
D. 单位时间里每增加1 mol N2,同时消耗3 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将如图所示实验装置的K闭合,下列判断正确的是

A. b电极上发生还原反应 B. 片刻后甲池中c(Cl-)增大
C. 电子沿Zn→a→b→Cu路径流动 D. 片刻后可观察到滤纸b点变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究碳酸钙与盐酸反应的反应速率,某同学通过实验测定碳酸钙固体与足量稀盐酸反应生成CO2的体积随时间的变化情况,绘制出下图所示的曲线甲。下列有关说法中不正确的是

A. 在0-t1、t1-t2、t2-t3中,t1-t2生成的CO2气体最多
B. 因反应放热,导致0-t1内的反应速率逐渐增大
C. 若用单位时间内CO2的体积变化来表示该反应的速率,则t2-t3时间内平均反应速率为![]() mLs-1
mLs-1
D. 将碳酸钙固体研成粉末,则曲线甲将变成曲线乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是

编号 | ① | ② | ③ | ④ |
气体X | HI | NH3 | H2 | NO |
气体Y | Cl2 | HCl | Cl2 | O2 |
A. ②>③>①>④ B. ③>①=④>②
C. ③>①>④>② D. ④>①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为________。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为____________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为____________。
(4)相同条件下,体积比为a∶b和质量比为a∶b的H2和O2的混合气体,其平均摩尔质量分别是______________和______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是一种常见的无机化合物,可形成CuSO4 .5H2O、CuSO4 .H2O等多种结 晶水合物,它可用作杀菌剂,还可用于电镀和电解精炼铜。冋答下列问题:
(1)CuSO4 .5H2O的俗名是________ 。
(2)工业利用“冶炼硫酸铜”(主要成分CuSO4含少量Fe2+、AsO2-、Ca2+等杂质)提纯 制备“电镀硫酸铜”(CuSO4 .H2O)的生产流程如下:

溶解所用的酸最适宜的是_____ ,氧化的产物中有比H3AsO4和______,调节pH时生成固体的主要成分除FeAsO4、Fe((OH)) 3外还有______,生成FeAsO4反应的离子方程是________,操作a需经过蒸发浓缩、____、过滤、洗涤、干燥等步骤,其中洗涤的过程中常用无水乙醇,其作用是______________________。

(3)用CuSO4溶液电解精炼铜的装置如图所示,粗铜中含 锌、银、铂杂质,阳极发生的电极反应式_______: 目前世界正在 大力开展用Cu+的络合物作电解质溶液制备纯铜的研究,电解Cu+的 络合物与电解CuSO4溶液相比较,优点是________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用如下反应制取P4:2Ca(PO4)2 +6SiO2+10C![]() 6CaSiO3+P4+10CO
6CaSiO3+P4+10CO
回答下列问题:
(1)基态硅原子的核外电子排布式为___。
(2)Si、P、S元素第一电离能大小关系为___。
(3)P4中P原子的杂化方式是___ ,P4的空间结构为___ ,键角∠PPP=___。
(4)与CO互为等电子的阴离子是___ (填化学式)。
(5)晶体硅与金刚石结构相似,下图为晶体硅的晶胞结构。已知硅原子的半径为r nm,晶体硅的密度是___g/cm3。

(6)硅的含氧化合物都以硅氧四面体(SiO4)作为基本结构单元,如图a所示,可简化为图b。
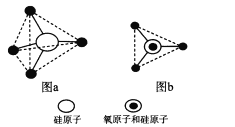
硅、氧原子通过共用氧原子形成各种不同的硅酸根负离子,如图c和图d,图c的化学式____________。在无限长链的硅酸根中硅氧原子之比为____。

硅、氧原子除可形成长链外,也可形成层状和立体网状结构。在立体网状结构中,硅、氧原子数之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),H=-akJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是( )
4NO(g)+6H2O(g),H=-akJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是( )
A.2分钟反应放出的热量值小于0.1akJ
B.用氧气表示0~2min的反应速率:v(O2)=0.05mol·L-1·min-1
C.2分钟内NH3的转化率是50%
D.2分钟末c(H2O)=0.6mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com