
【题目】硫酸铜是一种常见的无机化合物,可形成CuSO4 .5H2O、CuSO4 .H2O等多种结 晶水合物,它可用作杀菌剂,还可用于电镀和电解精炼铜。冋答下列问题:
(1)CuSO4 .5H2O的俗名是________ 。
(2)工业利用“冶炼硫酸铜”(主要成分CuSO4含少量Fe2+、AsO2-、Ca2+等杂质)提纯 制备“电镀硫酸铜”(CuSO4 .H2O)的生产流程如下:

溶解所用的酸最适宜的是_____ ,氧化的产物中有比H3AsO4和______,调节pH时生成固体的主要成分除FeAsO4、Fe((OH)) 3外还有______,生成FeAsO4反应的离子方程是________,操作a需经过蒸发浓缩、____、过滤、洗涤、干燥等步骤,其中洗涤的过程中常用无水乙醇,其作用是______________________。

(3)用CuSO4溶液电解精炼铜的装置如图所示,粗铜中含 锌、银、铂杂质,阳极发生的电极反应式_______: 目前世界正在 大力开展用Cu+的络合物作电解质溶液制备纯铜的研究,电解Cu+的 络合物与电解CuSO4溶液相比较,优点是________________,
【答案】胆矾或蓝矾 硫酸 Fe2(SO4)3 CaCO3 2H3AsO4+2Fe3++3CO32-=2FeAsO4↓+3H2O+3CO2↑ 冷却结晶 迅速除去晶体表面的水,防止与表面的水的形成CuSO45H2O Zn-2e-=Zn2+ Cu-2e-=Cu2+ 理论上制备相同质量的铜时,可以节省一半的电能
【解析】
(1)CuSO45H2O的俗名为胆矾或蓝矾;
(2)因为最后制取的为电镀硫酸铜CuSO4H2O,所以加入的酸最好为硫酸;亚铁离子能被过氧化氢氧化,所以产物中含有硫酸铁。调节pH时加入的试剂为碳酸钠,所以溶液中的钙离子与碳酸钠反应生成碳酸钙。调节pH时生成固体的主要成分除FeAsO4,说明铁离子和H3AsO4在碳酸根离子存在反应生成FeAsO4,同时产生二氧化碳,离子方程式为:2H3AsO4+2Fe3++3CO32-=2FeAsO4↓+3H2O+3CO2↑。因为要制备的是电镀硫酸铜,电镀硫酸铜含有一定量的结晶水,故操作a是蒸发浓缩、冷却结晶,过滤,洗涤,干燥。洗涤过程使用无水乙醇,利用乙醇和水任意比互溶,其作用是迅速除去晶体表面的水,防止与表面的水的形成CuSO45H2O。
(3)电解精炼铜中粗铜在阳极反应,粗铜中含 锌、银、铂杂质,最活泼的为锌,其次为铜,故电极反应为:Zn-2e-=Zn2+ , Cu-2e-=Cu2+;电解Cu+的 络合物与电解CuSO4溶液相比较,Cu+得到电子生成铜,与铜离子得到电子生成铜相比较,理论上制备相同质量的铜时,可以节省一半的电能。


科目:高中化学 来源: 题型:
【题目】在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:
(1)2 min末SO3的浓度;
(2)2 min内SO2的平均反应速率;
(3)2 min末SO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20mL,0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是

A. 在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-)
B. 在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+)
C. 在B点:c(OH-)﹦c(H+),c(Na+)﹦c(CH3COO-)
D. 在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. CH3-CH=CH-CH=CH2无顺反异构
C. 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D. 菲的结构简式为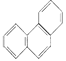 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.铁与稀硫酸反应的离子方程式:2Fe+6H+=2Fe3++3H2↑
B.实验室制氯气的化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.醋酸钠水解的离子方程式:CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
D.一水合氨在水溶液中的电离方程式:NH3·H2O![]() NH4++OHˉ
NH4++OHˉ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1 mol/L H2R溶液中滴加0.1 mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。已知pKa=﹣lgKa,二元弱酸H2R的pKa1=1.89,pKa2=7.21。下列有关说法错误的是

A. 溶液的导电性:点a弱于点b
B. 离子浓度c(R2-):点c小于点d
C. H2R + R2-=2HR-平衡常数>105,反应趋于完全
D. 点b时,y<7且![]() <1
<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857 ℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:

①Fe(CrO2)2中各元素化合价均为整数,则铬为_______价。
②高温氧化时反应的化学方程式为______________。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式______________。
(3)铬元素能形成含氧酸及含氧酸盐,若测得初始浓度为1 mol/L的铬酸(H2CrO4)溶液中各种含铬元素的微粒浓度为:c(CrO42-)=0.0005 mol/L、c(HCrO4-)=0.1035 mol/L、c(Cr2O72-)=a mol/L、则a =____,KHCrO4溶液中c(OH)_____c(H+)(填“>”、“<”或“=”),原因是__________________。
(4)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。处理含有Cr2O72-的污水方法通常为:用铁作电极电解污水,Cr2O72-被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为_____,若要处理含10 mol Cr2O72-的污水,则至少需要消耗的铁为_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3) = 3。下图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法错误的是

A. 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-)
B. 25℃时,H2CO3的一级电离平衡常数Ka1= 10-6
C. 25℃时,CO2饱和溶液的浓度是0.05 mol·L-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH 约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为1%
D. 25℃时,0.1 mol·L-1,的Na2CO3和0.1 mol·L-1的NaHCO3混合溶液中离子浓度的大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中不正确的是
A. 在同温同压下,等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,溶液呈碱性
C. 氢氧化钡晶体与氯化铵晶体的反应属于吸热反应
D. 常温下,0.1 mol·L-1的NaOH溶液和0.06 mol·L-1的H2SO4溶液等体积混合,混合溶液的pH=2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com