
【题目】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857 ℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:

①Fe(CrO2)2中各元素化合价均为整数,则铬为_______价。
②高温氧化时反应的化学方程式为______________。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式______________。
(3)铬元素能形成含氧酸及含氧酸盐,若测得初始浓度为1 mol/L的铬酸(H2CrO4)溶液中各种含铬元素的微粒浓度为:c(CrO42-)=0.0005 mol/L、c(HCrO4-)=0.1035 mol/L、c(Cr2O72-)=a mol/L、则a =____,KHCrO4溶液中c(OH)_____c(H+)(填“>”、“<”或“=”),原因是__________________。
(4)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。处理含有Cr2O72-的污水方法通常为:用铁作电极电解污水,Cr2O72-被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为_____,若要处理含10 mol Cr2O72-的污水,则至少需要消耗的铁为_______g。
【答案】+3 4Fe(CrO2)2+7O2+8Na2CO3=2Fe2O3+8Na2CrO4+8CO2 NaCrO2、Cr2(SO4)3 0.448 < H2CrO4完全电离,因此HCrO4-只发生电离,溶液显酸性,即c(OH-)<c(H+) 2H2O+2e=2OH+H2↑(或2H++2e=H2↑) 3360
【解析】
(1)①根据化合物中正负化合价的代数和等于0,Fe为+2价,O为-2价,可知Cr化合价为+3价;
②高温Fe(CrO2)2与O2、Na2CO3发生反应产生Fe2O3、CO2、Na2CrO4,根据电子守恒、原子守恒可得反应的化学方程式为4Fe(CrO2)2+7O2+8Na2CO3=2Fe2O3+8Na2CrO4+8CO2;
(2) Cr(OH)3是两性氢氧化物,其与NaOH溶液反应产生NaCrO2和水;与稀硫酸反应生成Cr2(SO4)3和水,反应的化学方程式是Cr(OH)3+NaOH= NaCrO2+2H2O、2Cr(OH)3+3H2SO4=Cr2(SO4)3+6H2O;故生成的两种盐的化学式分别为NaCrO2、Cr2(SO4)3;(3)根据Cr元素守恒可知:0.0005×1+0.1035×1+2a=1,解得a=0.448(mol/L);
在H2CrO4溶液中H2CrO4完全电离,产生的HCrO4-只发生部分电离,产生的CrO42-离子浓度远小于HCrO4-的浓度,所以溶液显酸性,则c(OH-)<c(H+);
(4)在阴极上发生还原反应,由于阳离子氧化性:H+>Na+,所以阴极的电极反应式为2H++2e=H2↑,也可以写为2H2O+2e=2OH+H2↑;
铁作阳极,被氧化生成Fe2+,电极反应式为Fe-2e-=Fe2+。反应产生的Fe2+被Cr2O72-氧化为Fe3+,Cr2O72-被还原为Cr3+,根据电子守恒得关系式:6Fe~12e-~6Fe2+~Cr2O72-,当有1molCr2O72-反应时,有6molFe在电极上被氧化,则10molCr2O72-反应消耗60molFe,故消耗Fe的质量为60mol×56g/mol=3360g。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 自发反应一定是熵增大,非自发反应一定是熵减小
B. 常温下pH=10碳酸钠的溶液,由水电离出的H+浓度等于1×10-10mol/L
C. 可溶性盐在水中完全电离是强电解质,而难溶性盐在水中只能部分电离
D. 对于反应2X(g)+Y(g)![]() Z(g)ΔH>0,增加X的量,ΔH不变
Z(g)ΔH>0,增加X的量,ΔH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是

编号 | ① | ② | ③ | ④ |
气体X | HI | NH3 | H2 | NO |
气体Y | Cl2 | HCl | Cl2 | O2 |
A. ②>③>①>④ B. ③>①=④>②
C. ③>①>④>② D. ④>①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是一种常见的无机化合物,可形成CuSO4 .5H2O、CuSO4 .H2O等多种结 晶水合物,它可用作杀菌剂,还可用于电镀和电解精炼铜。冋答下列问题:
(1)CuSO4 .5H2O的俗名是________ 。
(2)工业利用“冶炼硫酸铜”(主要成分CuSO4含少量Fe2+、AsO2-、Ca2+等杂质)提纯 制备“电镀硫酸铜”(CuSO4 .H2O)的生产流程如下:

溶解所用的酸最适宜的是_____ ,氧化的产物中有比H3AsO4和______,调节pH时生成固体的主要成分除FeAsO4、Fe((OH)) 3外还有______,生成FeAsO4反应的离子方程是________,操作a需经过蒸发浓缩、____、过滤、洗涤、干燥等步骤,其中洗涤的过程中常用无水乙醇,其作用是______________________。

(3)用CuSO4溶液电解精炼铜的装置如图所示,粗铜中含 锌、银、铂杂质,阳极发生的电极反应式_______: 目前世界正在 大力开展用Cu+的络合物作电解质溶液制备纯铜的研究,电解Cu+的 络合物与电解CuSO4溶液相比较,优点是________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同温度下,在2A(aq)![]() B(aq)反应体系中,A浓度与反应时间的关系如图所示。下列说法正确的是。( )
B(aq)反应体系中,A浓度与反应时间的关系如图所示。下列说法正确的是。( )

A.温度:T1>T2
B.a点的反应速率小于b点的反应速率
C.b点的反应速率为瞬时速率,难以在实验过程中直接测定
D.T1温度下,0~1h时间段,该反应的平均反应速率v(B)=0.9mol·L1·h1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用如下反应制取P4:2Ca(PO4)2 +6SiO2+10C![]() 6CaSiO3+P4+10CO
6CaSiO3+P4+10CO
回答下列问题:
(1)基态硅原子的核外电子排布式为___。
(2)Si、P、S元素第一电离能大小关系为___。
(3)P4中P原子的杂化方式是___ ,P4的空间结构为___ ,键角∠PPP=___。
(4)与CO互为等电子的阴离子是___ (填化学式)。
(5)晶体硅与金刚石结构相似,下图为晶体硅的晶胞结构。已知硅原子的半径为r nm,晶体硅的密度是___g/cm3。

(6)硅的含氧化合物都以硅氧四面体(SiO4)作为基本结构单元,如图a所示,可简化为图b。
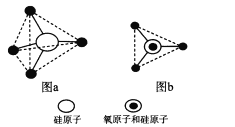
硅、氧原子通过共用氧原子形成各种不同的硅酸根负离子,如图c和图d,图c的化学式____________。在无限长链的硅酸根中硅氧原子之比为____。

硅、氧原子除可形成长链外,也可形成层状和立体网状结构。在立体网状结构中,硅、氧原子数之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物M的结构简式如下图所示,有关该化合物的叙述正确的是( )

A. 属于芳香烃B. 分子式为:C11H14O2
C. 最多有11个碳原子共面D. 能发生化学反应的类型只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次递增,其中Y与Z同主族。X与Y、Z与W均可形成如图所示的分子结构,且Z与W形成的分子中所有原子最外层均满足8电子稳定结构。下列说法中正确的是

A.原子半径:W > Z > Y > X
B.气态氢化物热稳定性:Y > Z > W
C.元素Z和W均存在两种以上的含氧酸
D.元素Z和W在自然界中均只能以化合态存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是空气的主要污染物之一,研究氮氧化物的性质对于防治空气污染有重要意义。回答下列问题:
(1)已知:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9 kJ/mol
NO(g)+![]() O2(g)=NO2(g) △H=-58.2kJ/mol
O2(g)=NO2(g) △H=-58.2kJ/mol
写出NO与臭氧(O3)反应生成NO2的热化学方程式_____________。
(2)温度为T1时,在三个容积均为1L的密闭容器中仅发生反应:
2NO(g)+O2(g)![]() 2NO2(g) △H<0
2NO2(g) △H<0
实验测得:v正=v(NO)消耗= 2v(O2) 消耗= k正c2(NO)·c(O2),v逆=v(NO2) 消耗= k逆c2 (NO2),k正、k逆为速率常数,受温度影响。

①温度为T1时,![]() =________;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m_________n(填“>”、“<“或“=”)。
=________;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m_________n(填“>”、“<“或“=”)。
②若容器Ⅱ中达到平衡时![]() =1,则NO的转化率为______,x=_______。
=1,则NO的转化率为______,x=_______。
③容器Ⅲ中起始时v正___________v逆(填“>”、“<”或“=”)。

④T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数Φ(NO2)随![]() 的变化如图所示,则A、B、C三点中NO的转化率最大的是___________;当
的变化如图所示,则A、B、C三点中NO的转化率最大的是___________;当![]() =2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的___________。
=2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com