
【题目】某有机化合物M的结构简式如下图所示,有关该化合物的叙述正确的是( )

A. 属于芳香烃B. 分子式为:C11H14O2
C. 最多有11个碳原子共面D. 能发生化学反应的类型只有2种
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质反应(表内物质均为反应物),反应刚开始时,放出H2的速率最大的是
编号 | 金属(粉末状) | 酸的浓度 | 酸的体积 | 反应起始温度 |
A | 0.1mol Zn | 6mol/L HNO3 | 10mL | 50℃ |
B | 0.1mol Fe | 3mol/L H2SO4 | 20mL | 30℃ |
C | 0.1mol Zn | 3mol/L H2SO4 | 10mL | 30℃ |
D | 0.1mol Zn | 3mol/L HCl | 40mL | 30℃ |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成 A、B 两室,向 A 中充入一定量 H2、O2 的混合气体,向 B 中充入 1 mol 空气,此时活塞的位置如图所示。

(1)A 室混合气体的物质的量为______,所含分子总数约______。
(2)实验测得 A 室混合气体的质量为 34 g,则该混合气体的密度是同温同压条件下氦气密度的______倍。
(3)若将 A 室 H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在______刻度,容器内气体压强与反应前气体压强之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下进行甲、乙、丙三组实验,三组实验均各取相同物质的量的盐酸,加入同一种镁铝合金粉末,产生气体,有关数据见表:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
生成气体/mL | 280 | 336 | 336 |
请回答下列问题:
(1)要算出盐酸的物质的量,题中作为计算依据的数据是___,求得的盐酸的溶质物质的量为___;
(2)求合金中Mg、Al的物质的量之比,题中可作为计算依据的数据是___,求得请务必写出计算过 程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是生物油的主要成分之一,乙酸制氢具有重要意义:
热裂解反应CH3COOH(g)→2CO(g)+2H2(g) △H=+2l3.7KJ·mol-1
脱酸基反应CH3COOH(g)→CH4(g)+CO2(g) △H=-33.5KJ·mol-1
(1)请写出CO与H2甲烷化的热化学方程式_________________________________。
(2)在密闭容器中,利用乙酸制氢,选择的压强为___________(填“较大”或“常压”)。其中温度与气体产率的关系如图:

①约650℃之前,脱酸基反应活化能低速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随着温度升高后,热裂解反应速率加快,同时______________________。
②保持其他条件不变,在乙酸气中掺杂一定量水,氢气产率显著提高而CO的产率下降,请用化学方程式表示:_________________________________。
(3)若利用合适的催化剂控制其他的副反应,温度为TK时达到平衡,总压强为PkPa,热裂解反应消耗乙酸20%,脱酸基反应消耗乙酸60%,乙酸体积分数为___________(计算结果保留l位小数);脱酸基反应的平衡常数Kp为___________kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KI用于分析试剂、感光材料制药和食品添加剂等。
制备原理如下:反应① 3I2+6 KOH =a KIO3+5KI+3H2O
反应② 3H2S+KIO3=3S↓+KI+3H2O

按照下列实验过程,请回答有关问题。
(1)启普发生器中发生的化学方程式为______________________,用该装置还可以制备___________(填一种气体化学式)。
(2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,待观察到______________________(填现象),停止滴人KOH溶液;然后______________________(填操作),待KIO3混合液和NaOH溶液气泡速率接近相同时停止通气。
(3)滴人硫酸溶液,并对KI混合液水浴加热,其目的是______________________。
(4)把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和___________,其中加入碳酸钡的作用是______________________。合并滤液和洗液,蒸发至析出结晶,滤出经于燥得成品。
(5)如果得到3.2g硫单质,则理论上制得的KI为___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用0.6mol·L-1 NaOH溶液480 mL。配制方法如下:
(1)配制该溶液应选用_______________mL容量瓶;
(2)用托盘天平准确称量__________g 固体NaOH;
(3)将称量好的NaOH固体放在500 mL大烧杯中,倒入约200 mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待__________________后,将烧杯中的溶液注入容量瓶中;
(4)用少量蒸馏水洗涤烧杯___________次,洗涤后的溶液___________________,轻轻晃动容量瓶,使溶液混合均匀;
(5)向容量瓶中加入蒸馏水,到液面______________时,改用___________加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,______________;
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是__________,偏低的是__________,对实验结果没有影响的是_______(填各选项的序号)。
A.所用的NaOH中混有少量Na2CO3
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其他条件不变,增大反应物的浓度能增大反应速率的原因是
A. 单位体积内分子数增多 B. 单位体积内活化分子数增多
C. 活化分子百分数增大 D. 单位体积内有效碰撞的次数增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用于提纯或分离物质的方法有:A.萃取 B.冷却结晶 C.蒸发结晶 D.分液 E.蒸馏 F.过滤 G.加热等,请将提纯或分离的序号填在后面横线上。
(1)分离氯化钠固体和碘固体的混合物____。
(2)从含少量KCl的KNO3溶液中提取KNO3___。
II.通过蒸馏除去自来水中含有的氯离子等杂质制取纯净水,如图所示:
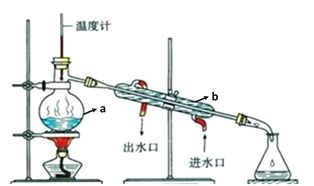
(1)写出下列仪器的名称:a____b_____
(2)仪器a中常加入少量___,这样做的目的是____。
(3)在进行实验操作前,应先___(a.点燃酒精灯;b.通冷凝水)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com