
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成 A、B 两室,向 A 中充入一定量 H2、O2 的混合气体,向 B 中充入 1 mol 空气,此时活塞的位置如图所示。

(1)A 室混合气体的物质的量为______,所含分子总数约______。
(2)实验测得 A 室混合气体的质量为 34 g,则该混合气体的密度是同温同压条件下氦气密度的______倍。
(3)若将 A 室 H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在______刻度,容器内气体压强与反应前气体压强之比为______。
【答案】2mol 1.204×1024 4.25 2 1:2
【解析】
(1)同温同压下,气体的物质的量之比等于其气体之比;根据N=nNA计算分子数目;
(2)计算A室中混合气体的平均摩尔质量,同温同压下气体的密度之比等于其摩尔质量之比;
(3)根据总质量、总物质的量列方程计算氢气与氧气物质的量,根据方程式计算反应后剩余气体物质的量,恢复原温度后最终两室中压强相等,体积之比等于其物质的量之比,可以确定活塞停留的位置;B室中空气物质的量不变、温度不变,反应前后压强之比与反应前后体积成反比。
(1)相同条件下,气体的体积之比等于其物质的量之比,1mol空气占容器总体积的1/3,空气和H2、O2 的混合气体的体积之比为1:2,则其物质的量之比为1:2,所以混合气体的物质的量为2mol,所含分子总数约为2×6.02×1023=1.204×1024,故答案为:2mol;1.204×1024;
(2)设H2的物质的量为x,O2的物质的量为y,则有关系式:x+y=2,2x+32y=34,解联立方程得,x= 1mol、y=1mol,该混合气体的平均相对分子质量=2×1/2+32×1/2=17,由同温同压条件下密度之比等于摩尔质量之比可知,则该混合气体的密度是同温同压条件下氦气密度的17/4=4.25倍, 故答案为:4.25;
(3) 若将 A 室 H2、O2的混合气体点燃引爆,由方程式可知氧气有谁剩余,剩余氧气为1mol-1mol×1/2=0.5mol,恢复原温度后最终两室中压强相等,体积之比等于其物质的量之比,则A、B两室的体积之比为0.5mol:1mol=1:2,则活塞停留在2刻度处;A室中空气物质的量不变、温度不变,反应前后压强之比与反应前后体积成反比,则容器内气体压强与反应前气体压强之比为2:4=1:2,故答案为:2;1:2。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B的浓度是原来的65%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B的浓度是原来的65%,则
A. 平衡向逆反应方向移动了 B. 物质B的质量分数增加了
C. 物质A的转化率减小了 D. a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1993年8月,国际原子量委员会确认我国张青莲教授测定的锑的相对原子质量(121.760)为标准原子量,已知锑有两种以上天然同位素,则121.760是( )
A.锑元素的质量与12C原子质量1/12的比值
B.一个锑原子的质量与12C原子质量1/12的比值
C.按各种锑的天然同位素的相对原子质量与这些同位素所占的一定百分比计算出的平均值
D.按各种锑的天然同位素质量数与这些同位素所占的一定百分比计算出的平均值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下。下列说法正确的是( )
已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
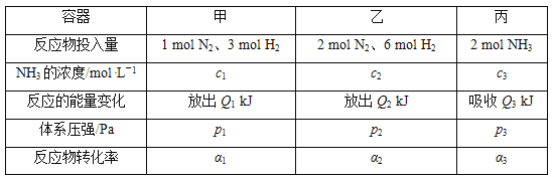
A. 2p1=2p3<p2
B. 达到平衡时丙容器中NH3的体积分数最大
C. α2+α3<1
D. Q1+Q3=92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真分析物质的量浓度的概念及其定义式并思考,下列溶液中溶质的物质的量浓度为1mol·L-1的是( )
A. 将40gNaOH溶解于1L水中
B. 将22.4L氯化氢气体溶于水配成1L溶液
C. 将1L10 mol·L-1的浓盐酸与9L水混合
D. 将10gNaOH溶解于水中配成250mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点为-105℃,沸点为79℃,140℃以上时易分解。并且Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOC12=4LCl+S+SO2。
(1)组装该电池必须在无水、无氧的条件下进行,原因是______________________。
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,反应的化学方程式为______________________。用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量之比为___________。
(3)甲同学设计如图所示的装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。
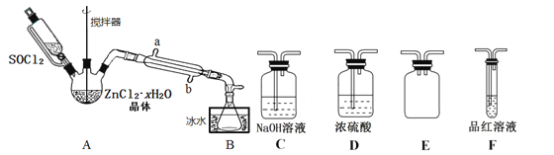
①用原理解释SOCl2在该实验中的作用:_________________________________。
②装置的连接顺序为A→B→______________________。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为___________(填序号)。
a.加入足量硝酸酸化的硝酸银溶液,充分反应 b.称得固体为n克
c.干燥 d.称取蒸干后的固体m克溶于水
e.过滤 f.洗涤
(4)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl2的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式为_________________________________。
②两同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加人足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加___________ | 若有白色沉淀生成 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加___________ | ___________ | 则没有发生上述副反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室进行下列实验, 括号内的实验用品都能用到的是
A. 苯的溴代(苯、溴水、试管)B. 蛋白质的盐析(试管、醋酸铅溶液、鸡蛋白溶液)
C. 钠的焰色反应(铂丝、氯化钠溶液、稀盐酸)D. 肥皂的制取(烧杯、玻璃棒、甘油)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物M的结构简式如下图所示,有关该化合物的叙述正确的是( )

A. 属于芳香烃B. 分子式为:C11H14O2
C. 最多有11个碳原子共面D. 能发生化学反应的类型只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开1molH-H键吸收的能量为436KJ,形成1molH-N键放出的能量为391KJ,根据化学方程式N2+3H2![]() 2NH3,反应完1molN2放出的能量为924KJ,则断开1molN≡N键吸收的能量是
2NH3,反应完1molN2放出的能量为924KJ,则断开1molN≡N键吸收的能量是
A.431KJ B.649KJ C.869KJ D.945.6KJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com