
【题目】已知断开1molH-H键吸收的能量为436KJ,形成1molH-N键放出的能量为391KJ,根据化学方程式N2+3H2![]() 2NH3,反应完1molN2放出的能量为924KJ,则断开1molN≡N键吸收的能量是
2NH3,反应完1molN2放出的能量为924KJ,则断开1molN≡N键吸收的能量是
A.431KJ B.649KJ C.869KJ D.945.6KJ
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成 A、B 两室,向 A 中充入一定量 H2、O2 的混合气体,向 B 中充入 1 mol 空气,此时活塞的位置如图所示。

(1)A 室混合气体的物质的量为______,所含分子总数约______。
(2)实验测得 A 室混合气体的质量为 34 g,则该混合气体的密度是同温同压条件下氦气密度的______倍。
(3)若将 A 室 H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在______刻度,容器内气体压强与反应前气体压强之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用0.6mol·L-1 NaOH溶液480 mL。配制方法如下:
(1)配制该溶液应选用_______________mL容量瓶;
(2)用托盘天平准确称量__________g 固体NaOH;
(3)将称量好的NaOH固体放在500 mL大烧杯中,倒入约200 mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待__________________后,将烧杯中的溶液注入容量瓶中;
(4)用少量蒸馏水洗涤烧杯___________次,洗涤后的溶液___________________,轻轻晃动容量瓶,使溶液混合均匀;
(5)向容量瓶中加入蒸馏水,到液面______________时,改用___________加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,______________;
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是__________,偏低的是__________,对实验结果没有影响的是_______(填各选项的序号)。
A.所用的NaOH中混有少量Na2CO3
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其他条件不变,增大反应物的浓度能增大反应速率的原因是
A. 单位体积内分子数增多 B. 单位体积内活化分子数增多
C. 活化分子百分数增大 D. 单位体积内有效碰撞的次数增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两种固体纯净物的溶解度曲线如图所示。在常温下,先在两支试管里分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里。下列说法正确的是( )


A. 乙溶液中溶质的质量分数增大
B. 装甲溶液的试管中剩余的固体减少
C. 试管里甲、乙物质的溶解度都增大
D. 两支试管里剩余的固体都增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备丙烯的方法有多种,具体如下(本题丙烯用C3H6表示):
(1)丙烷(C3H8)脱氢制备丙烯(C3H6)
由下图可得,C3H8(g)![]() C3H6(g)+H2(g),△H=_________kJ/.mol
C3H6(g)+H2(g),△H=_________kJ/.mol

(2)用惰性电极电解CO2的酸性溶液可得丙烯(C3H6),其原理如下图所示。则b的电极反应式为__________。

(3)以丁烯(C4H8)和乙烯(C2H4)为原料反应生成丙烯(C3H6)的方法被称为“烯歧化法”,反应为:C4H8(g)+C2H4(g)![]() 2C3H6(g) △H>0
2C3H6(g) △H>0
一定温度下,在一体积恒为VL的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化反应。
I.该反应达到平衡的标志是______________
a.反应速率满足:2v生成(C4H8)=v生成(C3H6)
b.C4H8、C2H4、C3H6的物质的量之比为1:1:2
c.混合气体的平均相对分子质量不再改变
d.C4H8、C2H4、C3H6的浓度均不再变化
Ⅱ.已知t1min时达到平衡状态,测得此时容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为![]() 。
。
①该时间段内的反应速率v(C4H8)= _______mol/(L·min)。(用只含m、V、t1的式子表示)。
②此反应的平衡常数K=______________。
③t1min时再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数_______![]() (填“>”“<”“=”)。
(填“>”“<”“=”)。
(4)“丁烯裂解法”是另一种生产丙烯的方法,但生产过程中伴有生成乙烯的副反应发生,具体反应如下:主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
①从产物的纯度考虑,丙烯和乙烯的质量比越高越好。则从下表现的趋势来看,下列反应条件最适宜的是__________(填字母序号)。
a.300℃0.1MPa b.700℃0.1MPa c.300℃0.5MPa d.700℃0.5MPa
②下图中,平衡体系中丙烯的百分含量随压强增大呈上升趋势,从平衡角度解释其可能的原因是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是
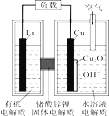
A. 整个反应过程中,氧化剂为O2
B. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
C. 放电时,当电路中通过0.1 mol电子的电量时,有0.1 mol Li+透过固体电解质向Cu极移动,有标准状况下1.12 L氧气参与反应
D. 通空气时,铜被腐蚀,表面产生Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用于提纯或分离物质的方法有:A.萃取 B.冷却结晶 C.蒸发结晶 D.分液 E.蒸馏 F.过滤 G.加热等,请将提纯或分离的序号填在后面横线上。
(1)分离氯化钠固体和碘固体的混合物____。
(2)从含少量KCl的KNO3溶液中提取KNO3___。
II.通过蒸馏除去自来水中含有的氯离子等杂质制取纯净水,如图所示:
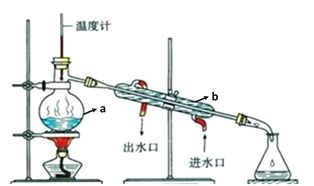
(1)写出下列仪器的名称:a____b_____
(2)仪器a中常加入少量___,这样做的目的是____。
(3)在进行实验操作前,应先___(a.点燃酒精灯;b.通冷凝水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】28g CO气体在1mol的氧气中燃烧后,所得的气体通过足量Na2O2固体中充分反应后,下列说法不正确的是( )
A. CO与氧气反应,只消耗了0.5mol氧气
B. 充分反应后Na2O2固体质量增加了28 g
C. 通过以上两步反应后余下氧气物质的量为0.5mol
D. 若2gH2替代 28g的CO发生上述反应,则Na2O2固体质量增加了2g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com