
����Ŀ����ҵ���������·�Ӧ��ȡP4��2Ca(PO4)2 +6SiO2+10C![]() 6CaSiO3+P4+10CO
6CaSiO3+P4+10CO
�ش��������⣺
(1)��̬��ԭ�ӵĺ�������Ų�ʽΪ___��
(2)Si��P��SԪ�ص�һ�����ܴ�С��ϵΪ___��
(3)P4��Pԭ�ӵ��ӻ���ʽ��___ ��P4�Ŀռ�ṹΪ___ �����ǡ�PPP=___��
(4)��CO��Ϊ�ȵ��ӵ���������___ (�ѧʽ)��
(5)���������ʯ�ṹ���ƣ���ͼΪ�����ľ����ṹ����֪��ԭ�ӵİ뾶Ϊr nm���������ܶ���___g/cm3��

(6)��ĺ��������ﶼ�Թ���������(SiO4)��Ϊ�����ṹ��Ԫ����ͼa��ʾ���ɼ�Ϊͼb��
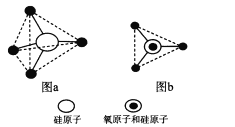
�衢��ԭ��ͨ��������ԭ���γɸ��ֲ�ͬ�Ĺ���������ӣ���ͼc��ͼd��ͼc�Ļ�ѧʽ____________�����������Ĺ�����й���ԭ��֮��Ϊ____��

�衢��ԭ�ӳ����γɳ����⣬Ҳ���γɲ�״��������״�ṹ����������״�ṹ�У��衢��ԭ����֮��Ϊ____��
���𰸡�1s22s22p63s23p2����[Ne]3s23p2 P>S>Si��Si<S<P sp3 �������� 60�� CN�� ![]() Si2O76�� 1��3 1��2
Si2O76�� 1��3 1��2
��������
��1��Siλ�ڵ�������IVA�壬14��Ԫ�أ���������Ų�ʽΪ1s22s22p63s23p2����[Ne]3s23p2��
��2��ͬ���ڴ������ҵ�һ����������IIA>IIIA��VA>VIA����˵�һ�����ܴ�С˳����P>S>Si��Si<S<P��
��3�����Ŀռ乹��Ϊ���������Σ���Pԭ�ӵ��ӻ���ʽ��sp3������Ϊ60�㣻
��4��CO�ļ۵�������Ϊ10��ԭ����Ϊ2�����N2��NO����CN������CO��Ϊ�ȵ����壬��������CN����
��5�����������ʯ�ṹ���ƣ���Խ��ߵ�1/4=2r������Խ���Ϊ8r���ó������ı߳�Ϊ![]() ��10��7cm�����ݾ����Ľṹ�������к���Siԭ�Ӹ���Ϊ8����˾���������Ϊ
��10��7cm�����ݾ����Ľṹ�������к���Siԭ�Ӹ���Ϊ8����˾���������Ϊ![]() ��28g����˾������ܶ�Ϊ
��28g����˾������ܶ�Ϊ![]() g/cm3��
g/cm3��
��6����ͼ��֪��aͼ�Ļ�ѧʽΪSiO44�����γɶ��۹����������SiO44��ͨ������1��Oԭ����������֪ͼc�Ļ�ѧʽΪSi2O76��������ͼd�ṹ��ÿ��SiO44��������SiO44��������1��Oԭ�ӣ�Si��Oԭ�Ӹ�����Ϊ1��(2��2��1/2)=1��3����������״�ṹ�У�ÿ��SiO44�����ĸ�SiO44��������1��Oԭ�ӣ�Si��Oԭ�Ӹ�����Ϊ1��(4��1/2)=1��2��


 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2 L���ܱ������У�X��Y��Z�������ʵ�����ʱ��ı仯������ͼ��ʾ��

��1��X��ת������______��
��2����ͼ���������ݽ��з������÷�Ӧ�Ļ�ѧ����ʽΪ______��
��3����Ӧ�ӿ�ʼ��2����ĩ����Z��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊv(Z)=__________��
��4������Ӧ���е���____min���÷�Ӧ�Ǵﵽƽ�⡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ͬ���칹����Ŀ����������ȷ����
A. �ױ������ϵ�һ����ԭ�ӱ���3��̼ԭ�ӵ����ȡ�������ò�����6��
B. CH3-CH=CH-CH=CH2��˳���칹
C. ����5��̼ԭ�ӵ�ij������������һ��ȡ���������3��
D. �ƵĽṹ��ʽΪ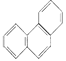 ���������ᷴӦ��������5��һ����ȡ����
���������ᷴӦ��������5��һ����ȡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����20mL0.1 mol/L H2R��Һ�еμ�0.1 mol/LNaOH��Һ����Һ��pH��NaOH��Һ����ı仯��ͼ��ʾ����֪pKa=��lgKa����Ԫ����H2R��pKa1=1.89��pKa2=7.21�������й�˵���������

A. ��Һ�ĵ����ԣ���a���ڵ�b
B. ����Ũ��c(R2-)����cС�ڵ�d
C. H2R + R2-=2HR-ƽ�ⳣ��>105����Ӧ������ȫ
D. ��bʱ��y<7��![]() <1
<1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�־���ս������Ľ����������ж��ּ�̬�����ʸ��۵�Ϊ1857 �档
(1)��ҵ���Ը��������Ҫ�ɷ���Fe(CrO2)2��Ϊԭ��ұ������������ͼ��ʾ��

��Fe(CrO2)2�и�Ԫ�ػ��ϼ۾�Ϊ���������Ϊ_______�ۡ�
�ڸ�������ʱ��Ӧ�Ļ�ѧ����ʽΪ______________��
(2)Cr(OH)3���������������д����ֱ���NaOH��ϡ���ᷴӦʱ���ɵ������εĻ�ѧʽ______________��
(3)��Ԫ�����γɺ����ἰ�������Σ�����ó�ʼŨ��Ϊ1 mol/L�ĸ���(H2CrO4)��Һ�и��ֺ���Ԫ�ص���Ũ��Ϊ��c(CrO42-)=0.0005 mol/L��c(HCrO4-)=0.1035 mol/L��c(Cr2O72-)=a mol/L����a =____��KHCrO4��Һ��c(OH)_____c(H+)������>������<������=������ԭ����__________________��
(4)ˮ�еĸ�Ԫ�ض�ˮ�ʼ������������ص������ã��������������������������Cr2O72-����ˮ����ͨ��Ϊ���������缫�����ˮ��Cr2O72-�����������ɵ����ӻ�ԭ��ΪCr3+�����ɵ�Cr3+�����������ɵ�OH�������Cr(OH)3������ȥ���������ϵĵ缫��ӦʽΪ_____����Ҫ������10 mol Cr2O72-����ˮ����������Ҫ���ĵ���Ϊ_______g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϡ��ˮ�д���������ƽ�⣺NH3��H2O![]() NH4+��OH������Ҫʹƽ�����淴Ӧ�����ƶ���ͬʱʹc(OH��)����Ӧ��������ʻ��ȡ�Ĵ�ʩ��
NH4+��OH������Ҫʹƽ�����淴Ӧ�����ƶ���ͬʱʹc(OH��)����Ӧ��������ʻ��ȡ�Ĵ�ʩ��
��NH4Cl���壻�������NaOH���壻��ˮ�������ȣ�����������MgSO4���塣
A. �٢ڢۢ� B. �ۢ� C. �� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pC������pH����ָ��ϡ��Һ�е�����Ũ�ȵij��ö����ĸ�ֵ����ij��Һ��ij���ʵ�Ũ��Ϊ1��10-3mol��L-1�������Һ�и����ʵ�pC=-lg(1��10-3) = 3����ͼΪ25��ʱH2CO3��Һ��pC-pHͼ��������Ũ��С��10-5 mol��L-1������Ϊ�����Ӳ�������������˵���������

A. ��Na2CO3��Һ�еμ�������pH����11ʱ����Һ����c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-)
B. 25��ʱ��H2CO3��һ������ƽ�ⳣ��Ka1= 10-6
C. 25��ʱ��CO2������Һ��Ũ����0.05 mol��L-1������1/5��CO2ת��ΪH2CO3������ʱ��Һ��pH ԼΪ5���ݴ˿ɵø��¶���CO2������Һ��H2CO3�ĵ����ԼΪ1%
D. 25��ʱ��0.1 mol��L-1����Na2CO3��0.1 mol��L-1��NaHCO3�����Һ������Ũ�ȵĴ�СΪc(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NH4��2SO4��һ�������·������·�Ӧ��4��NH4��2SO4![]() N2����6 NH3����3SO2����SO3����7H2O ����Ӧ�������ͨ��һ������BaCl2��Һ�У�������Һ�а�ɫ�������ɣ����в����������Һ���ݳ������鷢�ִ���Һ���ݳ���������ɫ����ζ����Һ���Ȼ���ǡ����ȫ��Ӧ������˵����ȷ����
N2����6 NH3����3SO2����SO3����7H2O ����Ӧ�������ͨ��һ������BaCl2��Һ�У�������Һ�а�ɫ�������ɣ����в����������Һ���ݳ������鷢�ִ���Һ���ݳ���������ɫ����ζ����Һ���Ȼ���ǡ����ȫ��Ӧ������˵����ȷ����
A�����ɳ����м���BaSO4������BaSO3����n��BaSO4����n��BaSO3��ԼΪ1��1
B�����ɳ����м���BaSO4������BaSO3����n��BaSO4����n��BaSO3��ԼΪ1��2
C�����ɳ����м���BaSO4������BaSO3����n��BaSO4����n��BaSO3��ԼΪ1��3
D������Һ���ݳ�������ֻ��N2�����������Һ������ֻ�н϶��NH4Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪijѧϰ��ȤС���Cu��ϡ���ᷴӦ�ĸĽ�ʵ��װ��ͼ��

��1������ͼ��װ����������������Ժ�װҩƷ��ʵ��ʱ���ȹر�a����b����װ��B���ƣ�ʹ֮��ϡ����Ӵ��������壬��______����ʵ���������̽�֮���ᣬ���ر�b������������Ŀ��Ϊ______��
��2����ͭ˿���ƣ�ʹ֮��ϡ����Ӵ���A��������______���Ժ�ͭ˿������ʹ֮��ϡ������룻��a����ѹE��ʹ������������A�У�A��������______��
��3����b�����漷ѹE��F����װ���ڵ����������屻����������Һ������գ�д��NO2����������������Һ��ַ�Ӧ�����ӷ���ʽ��______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com