
ЁОЬтФПЁП25ЁцЪБЃЌЯђ20mL0.1 mol/L H2RШмвКжаЕЮМг0.1 mol/LNaOHШмвКЃЌШмвКЕФpHЫцNaOHШмвКЬхЛ§ЕФБфЛЏШчЭМЫљЪОЁЃвбжЊpKa=ЉlgKaЃЌЖўдЊШѕЫсH2RЕФpKa1=1.89ЃЌpKa2=7.21ЁЃЯТСагаЙиЫЕЗЈДэЮѓЕФЪЧ

A. ШмвКЕФЕМЕчадЃКЕуaШѕгкЕуb
B. РызгХЈЖШc(R2-)ЃКЕуcаЁгкЕуd
C. H2R + R2-=2HR-ЦНКтГЃЪ§>105ЃЌЗДгІЧїгкЭъШЋ
D. ЕуbЪБЃЌy<7Чв![]() <1
<1
ЁОД№АИЁПD
ЁОНтЮіЁП
A. bЕуЪЧЯђ20mL 0.1molL-1H2R(ЖўдЊШѕЫс)ШмвКжаЕЮМг0.1molL-1NaOHШмвК20mLЃЌЕУЕНХЈЖШЮЊ0.05mol/LЕФNaHRШмвКЃЛaЕуЪЧЯђ20mL 0.1molL-1H2R(ЖўдЊШѕЫс)ШмвКжаЕЮМг0.1molL-1NaOHШмвК10mLЃЌЕУЕНХЈЖШОљЮЊ![]() mol/LЕФNaHRКЭH2RЕФЛьКЯШмвКЃЌгЩгквѕРызгЕФЫЎНтКЭЕчРыГЬЖШОљКмаЁЃЌвђДЫbЕуШмвКжаЕФРызгХЈЖШДѓгкaЕуЃЌЕМЕчФмСІЕуaШѕгкЕуbЃЌЙЪAе§ШЗЃЛ
mol/LЕФNaHRКЭH2RЕФЛьКЯШмвКЃЌгЩгквѕРызгЕФЫЎНтКЭЕчРыГЬЖШОљКмаЁЃЌвђДЫbЕуШмвКжаЕФРызгХЈЖШДѓгкaЕуЃЌЕМЕчФмСІЕуaШѕгкЕуbЃЌЙЪAе§ШЗЃЛ
B. cЕуШмвКШмжЪЮЊЕШЮяжЪЕФСПЕФNa2RЁЂNaHRЃЌХЈЖШОљЮЊ0.03mol/LЃЌdЕуШмвКжаШмжЪЮЊ![]() mol/L Na2RЃЌR2-ЫЎНтЕЋГЬЖШНЯаЁЃЌHR-МШЕчРыгжЫЎНтЕЋГЬЖШОљКмаЁЃЌвђДЫРызгХЈЖШc(R2-)ЃКЕуcаЁгкЕуdЃЌЙЪBе§ШЗЃЛ
mol/L Na2RЃЌR2-ЫЎНтЕЋГЬЖШНЯаЁЃЌHR-МШЕчРыгжЫЎНтЕЋГЬЖШОљКмаЁЃЌвђДЫРызгХЈЖШc(R2-)ЃКЕуcаЁгкЕуdЃЌЙЪBе§ШЗЃЛ
C. H2R + R2-=2HR-ЦНКтГЃЪ§K>105ЃЌЫЕУїЗДгІНјааЕФГЬЖШКмДѓЃЌЗДгІЧїгкЭъШЋЃЌЙЪCе§ШЗЃЛ
D. bЕуЪБЫљЕУШмвКЮЊ0.05mol/LЕФNaHRШмвКЃЌpKa2=7.21ЃЌKa2=10-7.21ЃЌдђHR-ЕФЕчРыГЬЖШДѓгкЫЎНтГЬЖШЃЌШмвКГЪЫсадЃЌyЃМ7ЃЌpKa1=1.89ЃЌдђKa1=10-1.89ЃЌKa1=![]() ЃЌЭЌРэKa2=
ЃЌЭЌРэKa2=![]() ЃЌдђKa1ЁСKa2=
ЃЌдђKa1ЁСKa2=![]() ЁС
ЁС![]() =
=![]() ЃЌвђДЫ
ЃЌвђДЫ![]() =
= ![]() =
=![]() =104.9ЃО1ЃЌЙЪDДэЮѓЃЛ
=104.9ЃО1ЃЌЙЪDДэЮѓЃЛ
Д№АИбЁDЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПБІМІБЛгўЮЊЁАЧрЭЦїжЎЯчЁБЃЌГіЭССЫДѓглЖІЁЂУЋЙЋЖІЁЂЩЂЪЯХЬЕШЮхЭђгрМўЧрЭЦїЁЃбаОПЧрЭЦїЃЈКЌCuЁЂSnЕШЃЉдкГБЪЊЛЗОГжаЗЂЩњЕФИЏЪДЖдгкЮФЮяБЃЛЄКЭаоИДгаживЊвтвхЁЃЯТЭМЮЊЧрЭЦїдкГБЪЊЛЗОГжаЗЂЩњЕчЛЏбЇИЏЪДЕФдРэЪОвтЭМЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ( )

A. ЧрЭЦїЗЂЩњЕчЛЏбЇИЏЪДЃЌЭМжаcзїИКМЋ
B. ГБЪЊЛЗОГжаCl-ХЈЖШДѓгаРћгкЖрПзЗлзДатЕФЩњГЩ
C. ШєЩњГЩ0.2 mol Cu2(OH)3ClЃЌдђЯћКФЕФO2ЬхЛ§ЮЊ4.48L
D. ЛЗОГжаЕФClгые§ЁЂИКСНМЋЗДгІЕФВњЮязїгУЩњГЩaЕФРызгЗНГЬЪНЮЊ2Cu2++3OH+Cl===Cu2 (OH)3ClЁ§
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮЊСЫбаОПЬМЫсИЦгыбЮЫсЗДгІЕФЗДгІЫйТЪЃЌФГЭЌбЇЭЈЙ§ЪЕбщВтЖЈЬМЫсИЦЙЬЬхгызуСПЯЁбЮЫсЗДгІЩњГЩCO2ЕФЬхЛ§ЫцЪБМфЕФБфЛЏЧщПіЃЌЛцжЦГіЯТЭМЫљЪОЕФЧњЯпМзЁЃЯТСагаЙиЫЕЗЈжаВЛе§ШЗЕФЪЧ

A. дк0-t1ЁЂt1-t2ЁЂt2-t3жаЃЌt1-t2ЩњГЩЕФCO2ЦјЬхзюЖр
B. вђЗДгІЗХШШЃЌЕМжТ0-t1ФкЕФЗДгІЫйТЪж№НЅдіДѓ
C. ШєгУЕЅЮЛЪБМфФкCO2ЕФЬхЛ§БфЛЏРДБэЪОИУЗДгІЕФЫйТЪЃЌдђt2-t3ЪБМфФкЦНОљЗДгІЫйТЪЮЊ![]() mLs-1
mLs-1
D. НЋЬМЫсИЦЙЬЬхбаГЩЗлФЉЃЌдђЧњЯпМзНЋБфГЩЧњЯпвв
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉБъзМзДПіЯТЃЌ1.92 gФГЦјЬхЕФЬхЛ§ЮЊ672 mLЃЌдђДЫЦјЬхЕФЯрЖдЗжзгжЪСПЮЊ________ЁЃ
ЃЈ2ЃЉдк25 ЁцЁЂ101 kPaЕФЬѕМўЯТЃЌЭЌжЪСПЕФCH4КЭAЦјЬхЕФЬхЛ§жЎБШЪЧ15ЁУ8ЃЌдђAЕФФІЖћжЪСПЮЊ____________ЁЃ
ЃЈ3ЃЉСНИіЯрЭЌШнЛ§ЕФУмБеШнЦїXЁЂYЃЌдк25 ЁцЯТЃЌXжаГфШыa g AЦјЬхЃЌYжаГфШыa g CH4ЦјЬхЃЌXгыYФкЕФбЙЧПжЎБШЪЧ4ЁУ11ЃЌдђAЕФФІЖћжЪСПЮЊ____________ЁЃ
ЃЈ4ЃЉЯрЭЌЬѕМўЯТЃЌЬхЛ§БШЮЊaЁУbКЭжЪСПБШЮЊaЁУbЕФH2КЭO2ЕФЛьКЯЦјЬхЃЌЦфЦНОљФІЖћжЪСПЗжБ№ЪЧ______________КЭ______________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСђЫсЭЪЧвЛжжГЃМћЕФЮоЛњЛЏКЯЮяЃЌПЩаЮГЩCuSO4 .5H2OЁЂCuSO4 .H2OЕШЖржжНс ОЇЫЎКЯЮяЃЌЫќПЩгУзїЩБОњМСЃЌЛЙПЩгУгкЕчЖЦКЭЕчНтОЋСЖЭЁЃеД№ЯТСаЮЪЬтЃК
(1)CuSO4 .5H2OЕФЫзУћЪЧ________ ЁЃ
(2)ЙЄвЕРћгУЁАвБСЖСђЫсЭЁБ(жївЊГЩЗжCuSO4КЌЩйСПFe2+ЁЂAsO2-ЁЂCa2+ЕШдгжЪ)ЬсДП жЦБИЁАЕчЖЦСђЫсЭЁБ(CuSO4 .H2O)ЕФЩњВњСїГЬШчЯТЃК

ШмНтЫљгУЕФЫсзюЪЪвЫЕФЪЧ_____ ЃЌбѕЛЏЕФВњЮяжагаБШH3AsO4КЭ______ЃЌЕїНкpHЪБЩњГЩЙЬЬхЕФжївЊГЩЗжГ§FeAsO4ЁЂFe((OH)) 3ЭтЛЙга______ЃЌЩњГЩFeAsO4ЗДгІЕФРызгЗНГЬЪЧ________,ВйзїaашОЙ§еєЗЂХЈЫѕЁЂ____ЁЂЙ§ТЫЁЂЯДЕгЁЂИЩдяЕШВНжшЃЌЦфжаЯДЕгЕФЙ§ГЬжаГЃгУЮоЫЎввДМЃЌЦфзїгУЪЧ______________________ЁЃ

(3)гУCuSO4ШмвКЕчНтОЋСЖЭЕФзАжУШчЭМЫљЪОЃЌДжЭжаКЌ аПЁЂвјЁЂВЌдгжЪЃЌбєМЋЗЂЩњЕФЕчМЋЗДгІЪН_______ЃК ФПЧАЪРНче§дк ДѓСІПЊеЙгУCu+ЕФТчКЯЮязїЕчНтжЪШмвКжЦБИДПЭЕФбаОПЃЌЕчНтCu+ЕФ ТчКЯЮягыЕчНтCuSO4ШмвКЯрБШНЯЃЌгХЕуЪЧ________________,
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕчЛЏбЇдкЮвУЧЕФЩњВњЩњЛюжаеМгадНРДдНживЊЕФЕиЮЛЁЃ
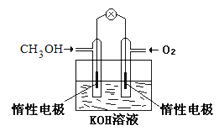
ЃЈ1ЃЉЂйШМСЯЕчГиЪЧвЛжжТЬЩЋЛЗБЃЁЂИпаЇЕФЛЏбЇЕчдДЁЃЩЯЭМЮЊМзДМШМСЯЕчГиЃЌдђИКМЋЗДгІЪНЮЊ____ЁЃ
ЂкгУМзДМШМСЯЕчГиЕчНт300mLБЅКЭЪГбЮЫЎЃЌдђЕчНтЕФЛЏбЇЗНГЬЪНЮЊ_________ЁЃЕчНтвЛЖЮЪБМфКѓЃЌЕБШмвКЕФpHжЕЮЊ13ЪБЃЌЯћКФO2ЕФжЪСПЮЊ______gЁЃЃЈКіТдШмвКЬхЛ§БфЛЏЃЌВЛПМТЧЫ№КФЃЉ
ЂлгУМзДМШМСЯЕчГиЕчНт2LЃЌ1mol/LСђЫсЭШмвКЃЌвЛЖЮЪБМфКѓЃКСНМЋЙВЪеМЏЕНБъзМзДПіЯТЕФЦјЬх89.6LЃЌдђЕчТЗжаЙВзЊвЦ_______molЕчзгЁЃ
ЃЈ2ЃЉРћгУЕчЛЏбЇдРэЃЌНЋNO2ЁЂO2КЭШлШкKNO3жЦГЩШМСЯЕчГиЃЌФЃФтЙЄвЕЕчНтЗЈРДДІРэКЌCr2O72-ЗЯЫЎЃЌШчЯТЭМЫљЪОЃЛЕчНтЙ§ГЬжаШмвКЗЂЩњЗДгІЃКCr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2OЁЃ
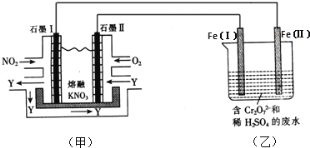
ЂйМзГиЙЄзїЪБЃЌNO2зЊБфГЩТЬЩЋЯѕЛЏМСYЃЌYЪЧN2O5ЃЌПЩбЛЗЪЙгУЃЌдђЪЏФЋЂђИННќЗЂЩњЕФЕчМЋЗДгІЪНЮЊ__ЁЃ
ЂкЯђЭъШЋЛЙдЮЊCr3+ЕФввГиЙЄвЕЗЯЫЎжаЕЮМгNaOHШмвКЃЌПЩНЋИѕвдCrЃЈOHЃЉ3ГСЕэЕФаЮЪНГ§ШЅЃЌвбжЊCrЃЈOHЃЉ3ДцдквдЯТШмНтЦНКтЃКCrЃЈOHЃЉ3ЃЈsЃЉ![]() Cr3+ЃЈaqЃЉ+3OH-ЃЈaqЃЉЃЌГЃЮТЯТCrЃЈOHЃЉ3ЕФШмЖШЛ§Ksp=cЃЈCr3+ЃЉc3ЃЈOH-ЃЉ=1.0ЁС10-32ЃЌвЊЪЙcЃЈCr3+ЃЉНЕжС10-5molL-1ЃЌШмвКЕФpHгІЕїжС________ЁЃ
Cr3+ЃЈaqЃЉ+3OH-ЃЈaqЃЉЃЌГЃЮТЯТCrЃЈOHЃЉ3ЕФШмЖШЛ§Ksp=cЃЈCr3+ЃЉc3ЃЈOH-ЃЉ=1.0ЁС10-32ЃЌвЊЪЙcЃЈCr3+ЃЉНЕжС10-5molL-1ЃЌШмвКЕФpHгІЕїжС________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЩЯРћгУШчЯТЗДгІжЦШЁP4ЃК2Ca(PO4)2 +6SiO2+10C![]() 6CaSiO3+P4+10CO
6CaSiO3+P4+10CO
ЛиД№ЯТСаЮЪЬтЃК
(1)ЛљЬЌЙшдзгЕФКЫЭтЕчзгХХВМЪНЮЊ___ЁЃ
(2)SiЁЂPЁЂSдЊЫиЕквЛЕчРыФмДѓаЁЙиЯЕЮЊ___ЁЃ
(3)P4жаPдзгЕФдгЛЏЗНЪНЪЧ___ ЃЌP4ЕФПеМфНсЙЙЮЊ___ ЃЌМќНЧЁЯPPP=___ЁЃ
(4)гыCOЛЅЮЊЕШЕчзгЕФвѕРызгЪЧ___ (ЬюЛЏбЇЪН)ЁЃ
(5)ОЇЬхЙшгыН№ИеЪЏНсЙЙЯрЫЦЃЌЯТЭМЮЊОЇЬхЙшЕФОЇАћНсЙЙЁЃвбжЊЙшдзгЕФАыОЖЮЊr nmЃЌОЇЬхЙшЕФУмЖШЪЧ___g/cm3ЁЃ

(6)ЙшЕФКЌбѕЛЏКЯЮяЖМвдЙшбѕЫФУцЬх(SiO4)зїЮЊЛљБОНсЙЙЕЅдЊЃЌШчЭМaЫљЪОЃЌПЩМђЛЏЮЊЭМbЁЃ
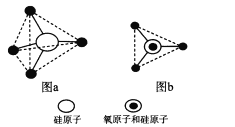
ЙшЁЂбѕдзгЭЈЙ§ЙВгУбѕдзгаЮГЩИїжжВЛЭЌЕФЙшЫсИљИКРызгЃЌШчЭМcКЭЭМdЃЌЭМcЕФЛЏбЇЪН____________ЁЃдкЮоЯоГЄСДЕФЙшЫсИљжаЙшбѕдзгжЎБШЮЊ____ЁЃ

ЙшЁЂбѕдзгГ§ПЩаЮГЩГЄСДЭтЃЌвВПЩаЮГЩВузДКЭСЂЬхЭјзДНсЙЙЁЃдкСЂЬхЭјзДНсЙЙжаЃЌЙшЁЂбѕдзгЪ§жЎБШЮЊ____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЩЯжЦБИБћЯЉЕФЗНЗЈгаЖржжЃЌОпЬхШчЯТЃЈБОЬтБћЯЉгУC3H6БэЪОЃЉЃК
(1)БћЭщ(C3H8)ЭбЧтжЦБИБћЯЉ(C3H6)
гЩЯТЭМПЩЕУЃЌC3H8(g)![]() C3H6(g)+H2(g)ЃЌЁїH=_________kJ/.mol
C3H6(g)+H2(g)ЃЌЁїH=_________kJ/.mol

(2)гУЖшадЕчМЋЕчНтCO2ЕФЫсадШмвКПЩЕУБћЯЉ(C3H6)ЃЌЦфдРэШчЯТЭМЫљЪОЁЃдђbЕФЕчМЋЗДгІЪНЮЊ__________ЁЃ

(3)вдЖЁЯЉ(C4H8)КЭввЯЉ(C2H4)ЮЊдСЯЗДгІЩњГЩБћЯЉ(C3H6)ЕФЗНЗЈБЛГЦЮЊЁАЯЉЦчЛЏЗЈЁБЃЌЗДгІЮЊЃКC4H8(g)+C2H4(g)![]() 2C3H6(g) ЁїH>0
2C3H6(g) ЁїH>0
вЛЖЈЮТЖШЯТЃЌдквЛЬхЛ§КуЮЊVLЕФУмБеШнЦїжаГфШывЛЖЈСПЕФC4H8КЭC2H4ЃЌЗЂЩњЯЉЬўЦчЛЏЗДгІЁЃ
IЃЎИУЗДгІДяЕНЦНКтЕФБъжОЪЧ______________
a.ЗДгІЫйТЪТњзу:2vЩњГЩ(C4H8)=vЩњГЩ(C3H6)
b.C4H8ЁЂC2H4ЁЂC3H6ЕФЮяжЪЕФСПжЎБШЮЊ1:1:2
c.ЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПВЛдйИФБф
d.C4H8ЁЂC2H4ЁЂC3H6ЕФХЈЖШОљВЛдйБфЛЏ
Ђђ.вбжЊt1minЪБДяЕНЦНКтзДЬЌЃЌВтЕУДЫЪБШнЦїжаn(C4H8)=mmolЃЌn(C2H4)=2mmolЃЌn(C3H6)=nmolЃЌЧвЦНКтЪБC3H6ЕФЬхЛ§ЗжЪ§ЮЊ![]() ЁЃ
ЁЃ
ЂйИУЪБМфЖЮФкЕФЗДгІЫйТЪv(C4H8)= _______mol/(LЁЄmin)ЁЃЃЈгУжЛКЌmЁЂVЁЂt1ЕФЪНзгБэЪОЃЉЁЃ
ЂкДЫЗДгІЕФЦНКтГЃЪ§K=______________ЁЃ
Ђлt1minЪБдйЭљШнЦїФкЭЈШыЕШЮяжЪЕФСПЕФC4H8КЭC2H4ЃЌдкаТЦНКтжаC3H6ЕФЬхЛ§ЗжЪ§_______![]() (ЬюЁА>ЁБЁА<ЁБЁА=ЁБ)ЁЃ
(ЬюЁА>ЁБЁА<ЁБЁА=ЁБ)ЁЃ
(4)ЁАЖЁЯЉСбНтЗЈЁБЪЧСэвЛжжЩњВњБћЯЉЕФЗНЗЈЃЌЕЋЩњВњЙ§ГЬжаАщгаЩњГЩввЯЉЕФИБЗДгІЗЂЩњЃЌОпЬхЗДгІШчЯТЃКжїЗДгІ:3C4H8![]() 4C3H6ЃЛИБЗДгІЃКC4H8
4C3H6ЃЛИБЗДгІЃКC4H8![]() 2C2H4
2C2H4
ЂйДгВњЮяЕФДПЖШПМТЧЃЌБћЯЉКЭввЯЉЕФжЪСПБШдНИпдНКУЁЃдђДгЯТБэЯжЕФЧїЪЦРДПДЃЌЯТСаЗДгІЬѕМўзюЪЪвЫЕФЪЧ__________ЃЈЬюзжФИађКХЃЉЁЃ
a.300Ёц0.1MPa b.700Ёц0.1MPa c.300Ёц0.5MPa d.700Ёц0.5MPa
ЂкЯТЭМжаЃЌЦНКтЬхЯЕжаБћЯЉЕФАйЗжКЌСПЫцбЙЧПдіДѓГЪЩЯЩ§ЧїЪЦЃЌДгЦНКтНЧЖШНтЪЭЦфПЩФмЕФдвђЪЧ_____ЁЃ

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉXЁЂYСНжжжїзхдЊЫиФмаЮГЩXY2аЭЛЏКЯЮяЃЌвбжЊXY2жаЙВга38ИіЕчзгЃЌЧвXY2ЮЊГЃМћдЊЫиаЮГЩЕФРызгЛЏКЯЮяЃЌдђXЁЂYдкдЊЫижмЦкБэжаЕФЮЛжУЗжБ№ЮЊ______ЁЂ_________ЃЌгУЕчзгЪНБэЪОИУЛЏКЯЮяаЮГЩЙ§ГЬ_____________ЁЃ
ЃЈ2ЃЉЯжгаaЁЋg 7жжЖЬжмЦкдЊЫиЃЌЫќУЧдкжмЦкБэжаЕФЮЛжУШчЯТЃЌЧыОнДЫЛиД№ЯТСаЮЪЬт:
ЂйдЊЫиЕФдзгМфЗДгІзюШнвзаЮГЩРызгМќЕФЪЧ____ЁЃ
AЃЎcКЭfЁЁЁЁЁЁЁЁЁЁЁЁЁЁBЃЎbКЭg CЃЎdКЭg DЃЎbКЭe
ЂкdгыgдЊЫиаЮГЩЕФЗжзгжаЫљгадзг_____(ЬюЁАЪЧЁБЛђЁАВЛЪЧЁБ)ЖМТњзузюЭтВуЮЊ8ЕчзгНсЙЙЁЃ
ЃЈ3ЃЉXЁЂYЁЂZКЭWДњБэдзгађЪ§вРДЮдіДѓЕФЫФжжЖЬжмЦкдЊЫиЃЌЫќУЧТњзувдЯТЬѕМўЃКЂйдЊЫижмЦкБэжаЃЌZгыYЯрСкЃЌZгыWвВЯрСкЃЛЂкYЁЂZКЭWШ§жждЊЫиЕФдзгзюЭтВуЕчзгЪ§жЎКЭЮЊ17ЁЃЧыЬюПеЃК
ЂйYЁЂZКЭWШ§жждЊЫиЪЧЗёЮЛгкЭЌвЛжмЦкЃЈЬюЁАЪЧЁБЛђЁАЗёЁБЃЉЃК________ЃЌРэгЩЪЧ________
ЂкXЁЂYЁЂZКЭWПЩзщГЩвЛЛЏКЯЮяЃЌЦфдзгИіЪ§жЎБШЮЊ8ЃК2ЃК4ЃК1ЁЃаДГіИУЛЏКЯЮяЕФЛЏбЇЪН_______ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com