
【题目】电化学在我们的生产生活中占有越来越重要的地位。
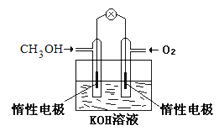
(1)①燃料电池是一种绿色环保、高效的化学电源。上图为甲醇燃料电池,则负极反应式为____。
②用甲醇燃料电池电解300mL饱和食盐水,则电解的化学方程式为_________。电解一段时间后,当溶液的pH值为13时,消耗O2的质量为______g。(忽略溶液体积变化,不考虑损耗)
③用甲醇燃料电池电解2L,1mol/L硫酸铜溶液,一段时间后:两极共收集到标准状况下的气体89.6L,则电路中共转移_______mol电子。
(2)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-废水,如下图所示;电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
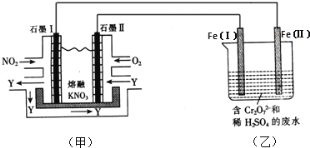
①甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨Ⅱ附近发生的电极反应式为__。
②向完全还原为Cr3+的乙池工业废水中滴加NaOH溶液,可将铬以Cr(OH)3沉淀的形式除去,已知Cr(OH)3存在以下溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5molL-1,溶液的pH应调至________。
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5molL-1,溶液的pH应调至________。
【答案】CH3OH-6e-+8OH-=CO32-+6H2O 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 0.24g 8 O2+4e-+2N2O5=4NO3- 5
2NaOH+H2↑+Cl2↑ 0.24g 8 O2+4e-+2N2O5=4NO3- 5
【解析】
(1) ①以KOH溶液作电解质溶液,甲醇燃料电池总反应式为2CH3OH+3O2+4OH-=2CO32-+6H2O,分析反应中元素化合价变化可确定CH3OH通入的一极为负极,据此写电极反应式。
②甲醇燃料电池总反应式2CH3OH+3O2+4OH-=2CO32-+6H2O,电解饱和食盐水总反应式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,分析两个反应中的电子转移数目,结合甲醇燃料电池与电解池电子得失守恒找出关系式解答。
2NaOH+H2↑+Cl2↑,分析两个反应中的电子转移数目,结合甲醇燃料电池与电解池电子得失守恒找出关系式解答。
③根据电解硫酸铜的反应式2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4可确定一定量CuSO4电解产生的气体物质的量,可判断CuSO4电解完全后还有部分水被电解,以此分析解答。
2Cu+O2↑+2H2SO4可确定一定量CuSO4电解产生的气体物质的量,可判断CuSO4电解完全后还有部分水被电解,以此分析解答。
(2) ①根据图示NO2转化为N2O5,由氮元素化合价的变化确定石墨I为负极,电解质为熔融KNO3,通入O2和N2O5一极转化为NO3-,确定石墨II为正极,再写电极反应式。
②Cr(OH)3沉淀完全时溶液中离子浓度有溶度积关系:c(Cr3+)·c3(OH-)=Ksp,再结合水的离子积常数计算溶液中pH。
(1) ①图示为甲醇燃料电池,电解质溶液为KOH溶液,电池总反应为2CH3OH+3O2+4OH-=2CO32-+6H2O,CH3OH中碳元素化合价由-2价升高到CO32-中的+4价,失去电子,所以通入CH3OH的一极为负极,负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O。
②电解饱和食盐水时生成NaOH和Cl2、H2,其化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。电解一段时间后溶液中的c(H+)=10-13mol/L,则电解生成NaOH的物质的量浓度c(NaOH)=c(OH-)=
2NaOH+H2↑+Cl2↑。电解一段时间后溶液中的c(H+)=10-13mol/L,则电解生成NaOH的物质的量浓度c(NaOH)=c(OH-)=![]() =
=![]() =0.1mol/L,即生成NaOH的物质的量n(NaOH)=0.3L×0.1mol/L=0.03mol,根据甲醇燃料电池与电解池电子得失守恒有:CH3OH~
=0.1mol/L,即生成NaOH的物质的量n(NaOH)=0.3L×0.1mol/L=0.03mol,根据甲醇燃料电池与电解池电子得失守恒有:CH3OH~![]() O2~6e-~6NaOH,则消耗O2质量m(O2)=
O2~6e-~6NaOH,则消耗O2质量m(O2)=![]() ·n(NaOH)·M(O2)=
·n(NaOH)·M(O2)=![]() ×0.03mol×32g/mol=0.24g。
×0.03mol×32g/mol=0.24g。
③2L溶液中硫酸铜物质的量n(CuSO4)=2L×1mol/L=2mol,两极共收集气体物质的量=![]() =4mol,根据电解反应方程式2CuSO4+2H2O
=4mol,根据电解反应方程式2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4知2molCuSO4完全电解只能生成1molO2(小于4mol);说明后来电解水:2H2O
2Cu+O2↑+2H2SO4知2molCuSO4完全电解只能生成1molO2(小于4mol);说明后来电解水:2H2O![]() 2H2↑+O2↑,电解水生成的气体物质的量为4mol-1mol=3mol。分析两步电解方程式可知:电解2molCuSO4转移4mole-,电解水时生成3mol气体转移4mole-,所以电路中共转移电子物质的量=4mole-+4mole-=8mole-,即8mol电子。
2H2↑+O2↑,电解水生成的气体物质的量为4mol-1mol=3mol。分析两步电解方程式可知:电解2molCuSO4转移4mole-,电解水时生成3mol气体转移4mole-,所以电路中共转移电子物质的量=4mole-+4mole-=8mole-,即8mol电子。
(2) ①甲池为NO2、O2和熔融KNO3组成的燃料电池,由图示知电池工作时通入NO2的一极产生N2O5,氮元素的化合价由+4价升高到+5价,失去电子,故石墨I作负极,所以石墨II作正极;且电解质是熔融KNO3,所以通入O2和N2O5转化为NO3-,则石墨Ⅱ附近发生的电极反应为O2+4e-+2N2O5=4NO3-。
②要使c(Cr3+)降至10-5molL-1,则此时溶液中c(OH-)=![]() =
=![]() =10-9mol/L,c(H+)=
=10-9mol/L,c(H+)=![]() =
=![]() =10-5mol/L,pH=-lg10-5=5,即溶液的pH应调至5。
=10-5mol/L,pH=-lg10-5=5,即溶液的pH应调至5。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:A _______ ,B________,C________,D________,E__________
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:____________ 。
(3)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式:______________ 。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)_______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 0.1mol/L的FeCl3溶液与0.01mol/L的FeCl3溶液中,Fe3+的浓度之比大于10
B. 常温下,浓度均为0.1 mol·L-1的①醋酸、②盐酸、③醋酸钠溶液,水的电离程度的顺序为③>①>②
C. 将相同体积的pH=3的硫酸和pH=11的NaOH溶液混合,所得溶液一定为中性
D. 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是a>c>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)泡沫灭火器的灭火原理是(用离子方程式表示)_____________________。
(2)①已知T℃时,Kw=1×10-12,在该温度时,将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=____。
②某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- ![]() H++A2-,则NaHA溶液中,写出符合原子(物料)守恒的各粒子浓度关系的等式_____________
H++A2-,则NaHA溶液中,写出符合原子(物料)守恒的各粒子浓度关系的等式_____________
(3)pH=2的两种一元酸HA和HB,体积均为100 mL,稀释过程中pH与溶液体积的关系如图。
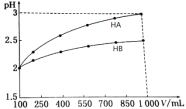
①则NaB水溶液是否呈中性?原因?______________(用离子方程式表示)。
②用NaOH溶液滴定HB溶液,指示剂宜选择_________,滴定终点现象为____________。
A.甲基橙 B.酚酞 C.石蕊
(4)NaHSO3溶液呈酸性,则溶液中,各离子浓度由大到小的顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1 mol/L H2R溶液中滴加0.1 mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。已知pKa=﹣lgKa,二元弱酸H2R的pKa1=1.89,pKa2=7.21。下列有关说法错误的是

A. 溶液的导电性:点a弱于点b
B. 离子浓度c(R2-):点c小于点d
C. H2R + R2-=2HR-平衡常数>105,反应趋于完全
D. 点b时,y<7且![]() <1
<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气可以制备大量的化工原料。请回答下列问题:
(1)由天然气制备合成气(CO和H2),进而可合成H2C2O4。
①欲加快H2C2O4溶液使5mL0.01mol/L酸性KMnO4溶液褪色,可采取的措施有__________、_______________(写两点)。
②下列可以证明H2C2O4是弱酸的是___________。
A.H2C2O4可以分解为CO、CO2和H2O
B.常温下,0.1mol/LNaHC2O4溶液中c(HC2O4-)+c(C2O42-)<0.lmol/L
C.0.1mol/LH2C2O4溶液25mL可以消耗0.1mol/LNaOH溶液50mL
D.常温下,0.05mol/L的H2C2O4溶液pH≈4
(2)已知:①CO(g)+H2(g)![]() C(s)+H2O(g) △H1=-130kJ/mol
C(s)+H2O(g) △H1=-130kJ/mol
②CH4(g)![]() C(s)+2H2(g) △H2=+76kJ/mol
C(s)+2H2(g) △H2=+76kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H20(g) △H3=+41kJ/mol
CO(g)+H20(g) △H3=+41kJ/mol
则CH4(g)+CO2(g)![]() 2H2(g)+2CO(g) △H=________。
2H2(g)+2CO(g) △H=________。
(3)向2L容器中通入3molCO2、3molCH4,在不同温度下,以镍合金为催化剂,发生反应:CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)。平衡体系中CH4和CO2的体积分数如下图。
2H2(g)+2CO(g)。平衡体系中CH4和CO2的体积分数如下图。
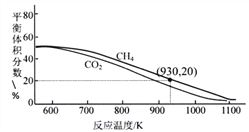
①高温下该反应能自发进行的原因是______________,930K时的平衡常数K=___________(保留两位小数)。
②请解释图中曲线随温度变化的原因______________。
③在700~1100K内,同温度下平衡转化率:CO2________CH4(填“大于”、“ 小于”或“等于”),结合(2)提供的反应分析,其原因可能是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgSO4固体。
A. ①②③⑤ B. ③⑥ C. ③ D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 碳酸钙跟醋酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
B. 硫酸铝溶液中加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH![]()
C. 向足量的溴化亚铁溶液中通入少量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D. 碳酸氢钠溶液与足量的氢氧化钡溶液混合:Ba2++2OH-+2HCO![]() =BaCO3↓+CO
=BaCO3↓+CO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。

已知:lg X=lg c(CO32-)/c(HCO3-)或lg c(HCO3-)/c(H2CO3),下列叙述正确的是( )
A. 曲线m表示pH与c(HCO3-)/c(H2CO3)的变化关系
B. 当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C. Ka1(H2CO3)=1.0×10-6.4
D. 25 ℃时,CO32-+H2O![]() HCO3-+OH-的平衡常数为1.0×10-7.6
HCO3-+OH-的平衡常数为1.0×10-7.6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com