
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3) = 3。下图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法错误的是

A. 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-)
B. 25℃时,H2CO3的一级电离平衡常数Ka1= 10-6
C. 25℃时,CO2饱和溶液的浓度是0.05 mol·L-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH 约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为1%
D. 25℃时,0.1 mol·L-1,的Na2CO3和0.1 mol·L-1的NaHCO3混合溶液中离子浓度的大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
【答案】C
【解析】
A. 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中存在电荷守恒为:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-),选项A正确;B、25℃时,pH等于11时,c(HCO3-)= c(H2CO3),H2CO3的一级电离平衡常数Ka1=![]() =
=![]() =10-6,选项B正确;C. 25℃时,CO2饱和溶液的浓度是0.05 mol·L-1,其中1/5的CO2转变为H2CO3,即H2CO3的浓度为0.01 mol·L-1,若此时溶液的pH约为5,即c(H+)=10-5mol/L,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为
=10-6,选项B正确;C. 25℃时,CO2饱和溶液的浓度是0.05 mol·L-1,其中1/5的CO2转变为H2CO3,即H2CO3的浓度为0.01 mol·L-1,若此时溶液的pH约为5,即c(H+)=10-5mol/L,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为![]() ,选项C错误;D. 25℃时,0.1 mol·L-1,的Na2CO3和0.1 mol·L-1的NaHCO3混合溶液呈碱性,碳酸根离子的水解程度大于碳酸氢根离子的水解,离子浓度的大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),选项D正确。答案选C。
,选项C错误;D. 25℃时,0.1 mol·L-1,的Na2CO3和0.1 mol·L-1的NaHCO3混合溶液呈碱性,碳酸根离子的水解程度大于碳酸氢根离子的水解,离子浓度的大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),选项D正确。答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1 molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g) ![]() 2HI(g),下列说法正确的是
2HI(g),下列说法正确的是
A. 保持容器容积不变,向其中加入1molH2,化学反应速率不变
B. 保持容器容积不变,向其中加入1molAr,化学反应速率增大
C. 保持容器内气体压强不变,向其中加入1molAr,化学反应速率不变
D. 保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),化学反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C 表示10s内反应的平均反应速率为____________。
(2)反应前A的物质的量浓度是_______________。
(3)10s末,生成物D的浓度为______________________。
(4)A 平衡转化率______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是
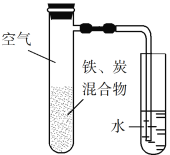
A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年11月16日,国土资源部召开新闻发布会,宣布天然气水合物,即“可燃冰”新矿种获得国务院批准,成为我国第173个矿种。“可燃冰”主要成分的分子式是CH4·8H2O,一旦温度升高或压强降低,甲烷气就会逸出,固体水合物便趋于崩解。“可燃冰”将成为人类的后续能源。
(1)将320 g可燃冰释放的甲烷完全燃烧生成液态水时,可放出1 780.6 kJ的能量,则表示甲烷燃烧热的热化学方程式是__________________。
(2)CH4不仅是优质的气体燃料,还能利用它和CO2重整,发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),获得合成气(主要成分为CO、H2),从而减少温室气体的排放。在一定条件下CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。则y点:v(正)____(填“>”、“=”或“<”,下同)v(逆);压强:p1____p2;该反应的ΔH____0。
2CO(g)+2H2(g),获得合成气(主要成分为CO、H2),从而减少温室气体的排放。在一定条件下CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。则y点:v(正)____(填“>”、“=”或“<”,下同)v(逆);压强:p1____p2;该反应的ΔH____0。
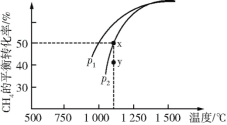
(3)在恒温、p2下,在一容积可变的容器中,达到平衡状态x时四种气体的物质的量均为1 mol,若此时再充入四种气体各1 mol,则平衡____(填“向左”、“向右”或“不”)移动。
(4)一定条件下,CH4还可与NO2反应,改善雾霾天气,其化学方程式为CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g),在恒温恒容下,下列可以判断该反应达到平衡状态的是____(填序号)。
CO2(g)+2H2O(g)+N2(g),在恒温恒容下,下列可以判断该反应达到平衡状态的是____(填序号)。
a.v逆(N2)=2v正(H2O)
b.混合气体的密度不再变化
c.混合气体的物质的量不再变化
d.单位时间内有1 mol NO2消耗同时消耗1 mol CO2
e.混合气体的平均相对分子质量不变
f.CH4与CO2的物质的量之比不再发生变化
(5)在恒温恒容下,使1 mol CH4(g)与2 mol NO2反应,达平衡后,再往反应器中分别充入下列气体,可以使CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g)中NO2转化率增大的是____(填序号)。
CO2(g)+2H2O(g)+N2(g)中NO2转化率增大的是____(填序号)。
A.CH4 B.CO2
C.物质的量之比为1∶2的CH4与NO2 D.N2
(6)CH4还可以运用到电化学中,某课外小组用CH4为燃料,空气为氧化剂,稀土金属材料作电极,电浮选凝聚法处理污水,设计如图所示装置。则甲烷 燃料电池的总反应式为______。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(如图),A物质的化学式是______。
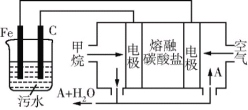
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)( )
|
|
|
|
A.实验室制取溴苯 | B.实验室制取乙酸乙酯 | C.石油分馏 | D.实验室制取硝基苯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丁香酚可作为合成香料的原料,其结构简式如下图所示。下列有关叙述正确的是( )
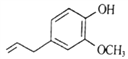
A. 异丁香酚属于芳香族化合物,分子式为C10H14O2
B. 该物质能使酸性高锰酸钾溶液褪色
C. 1mol该物质与足量H2发生加成反应,最多可消耗1molH2
D. 分子中所有原子有可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离方程式:H2O![]() H++OH-。下列叙述中,正确的是
H++OH-。下列叙述中,正确的是
A. 升高温度,Kw增大,pH不变
B. 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C. 向水中加入少量硫酸,c(H+)增大,Kw不变
D. 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com