
【题目】在一密闭容器中充入1 molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g) ![]() 2HI(g),下列说法正确的是
2HI(g),下列说法正确的是
A. 保持容器容积不变,向其中加入1molH2,化学反应速率不变
B. 保持容器容积不变,向其中加入1molAr,化学反应速率增大
C. 保持容器内气体压强不变,向其中加入1molAr,化学反应速率不变
D. 保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),化学反应速率不变
科目:高中化学 来源: 题型:
【题目】(1)现向含AgCl的饱和溶液中:
①加入AgNO3固体,则c(Ag+)______,c(Cl-)______;(填“变大”、“变小”或“不变”,下同)
②加入NaI固体,则c(Ag+)______,c(Cl-)______。
(2)牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:Ca5(PO4)3(s)![]() 5Ca2+(aq)+3PO43-(aq)+OH-(aq)。进食后细菌和酶作用于食物,产生有机酸,使牙齿受到腐蚀,叙述其原因_____________。已知Ca5(PO4)3F(固)的溶解度比Ca5(PO4)3OH更小,质地更坚固。若牙膏中添加含F-的氟化物后,能有效防止龋齿,请用离子方程式解释原因_________________________________。
5Ca2+(aq)+3PO43-(aq)+OH-(aq)。进食后细菌和酶作用于食物,产生有机酸,使牙齿受到腐蚀,叙述其原因_____________。已知Ca5(PO4)3F(固)的溶解度比Ca5(PO4)3OH更小,质地更坚固。若牙膏中添加含F-的氟化物后,能有效防止龋齿,请用离子方程式解释原因_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某草酸(H2C2O4)溶液的浓度,进行如下实验:
取25.00mL某草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为0.10molL-1的KMnO4溶液滴定到终点,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O试回答:
(1)实验中,标准液KMnO4溶液应装在________式滴定管中,因为_____________;
(2)实验中眼睛注视_________________,直至滴定终点;判断到达终点的现象是___________________________________________ ;
(3)若实验所用KMnO4溶液体积为21.00mL,则草酸溶液的浓度为_______________;
(4)实验中,下列操作(其它操作均正确),会对所测草酸浓度有什么影响?(填偏大、偏小、无影响)
A.滴定前仰视刻度,滴定后俯视刻度________________________;
B.锥形瓶在盛放待测液前未干燥,有少量蒸馏水______________________________;
C.滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 请计算 68.4g 蔗糖完全水解生成葡萄糖的物质的量是多少___________。
(2)葡萄糖在酒化酶的作用下可以分解为酒精和二氧化碳。请计算用 684g 蔗糖为原料制取葡萄糖,并由葡萄糖完全转化为酒精,生成酒精的物质的量是多少___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应H2(g)+I2(g)![]() 2HI(g)达到化学平衡状态的标志是
2HI(g)达到化学平衡状态的标志是
A. 单位时间内生成nmolH2,同时就有nmolHI 生成
B. 单位时间内有nmolH2生成,同时就有nmolI2生成
C. 容器内气体的总压强不随时间的变化而变化
D. 容器内混合气体的颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
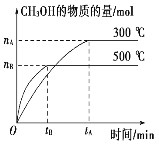
(1)该反应的平衡常数表达式K=_______;
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表 示的化学反应速率是______(用 nB,tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是_________(填字母,下同)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 对于2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
B. 已知, N2 (g) + 3 H2(g)![]() 2NH3(g) △H﹤0 ,为提高氨的产率,理论上应采取降低温度的措施
2NH3(g) △H﹤0 ,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g)△H﹤0,达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)△H﹤0,达平衡后,升高温度体系颜色变深
D. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3) = 3。下图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法错误的是

A. 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-)
B. 25℃时,H2CO3的一级电离平衡常数Ka1= 10-6
C. 25℃时,CO2饱和溶液的浓度是0.05 mol·L-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH 约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为1%
D. 25℃时,0.1 mol·L-1,的Na2CO3和0.1 mol·L-1的NaHCO3混合溶液中离子浓度的大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com